Calculadora de molaridad
Esta calculadora de molaridad está hecha para convertir la concentración másica de cualquier solución a concentración molar (o recalcular de gramos por ml a moles). También puedes calcular la masa de una sustancia necesaria para alcanzar una molaridad deseada. Este artículo te brindará la definición y la fórmula de molaridad.
Para tener una comprensión completa del tema, es importante que entiendas la definición de mol, leas sobre las unidades de molaridad y compares dos conceptos confusos: fórmula de molaridad y la fórmula de molalidad. Además, te presentamos algunos ejemplos interesantes de soluciones molares y un breve tutorial paso a paso sobre cómo calcular la molaridad de una solución concentrada.
Al final, podrás aprender la definición de valoración química y descubrir cómo hallar la concentración molar utilizando el método de valoración.
Cómo utilizar la calculadora de molaridad
La calculadora de molaridad es sencilla y cómoda, y pronto lo descubrirás. Pero, ¿sabías lo importante que es calcular la molaridad? Mantener la calidad de los productos y el cumplimiento de las normas de seguridad exige determinar la molaridad de determinados compuestos químicos o aditivos en la industria alimentaria y de bebidas.
-
Si conoces la concentración de la solución, introdúcela en la 3ª variable de la calculadora. Un dato interesante es que la concentración en masa es igual a su densidad para una sustancia pura. La unidad por defecto aquí es g/mL, gramos por mililitro, pero puedes cambiarla desde las opciones dadas; asegúrate de cambiar la unidad antes de introducir el valor.
-
A continuación, introduce la masa molar de la sustancia. La unidad por defecto es gramos por mol, pero puedes cambiarla antes por otras unidades de uso común.
-
Ahora verás cómo la calculadora determina instantáneamente la molaridad. La unidad por defecto es moles (M). Puedes cambiarla según tus necesidades a partir de la lista de opciones.
-
Pero, ¿qué hacer si no tienes la concentración másica de la sustancia? ¿Cómo calcular ahora la molaridad? Nuestra herramienta también tiene la respuesta para eso. En esta situación, deja vacía la concentración en masa.
-
Introduce la masa de la sustancia en gramos o cambia la unidad si es necesario.
-
Por último, introduce el volumen de la solución.
-
Nuestra herramienta es lo suficientemente inteligente como para determinar la concentración másica y la molaridad a partir de la información que nos has proporcionado.
Veamos un ejemplo. La sustancia que deseas es ácido sulfúrico, y la masa molar es 98 g/mol con una concentración másica de 10 g/ml. Si introduces estos valores en la calculadora, la molaridad será 102.0408 M.
Ahora, imagina que no conoces la concentración másica del ácido. En su lugar, tienes la masa y el volumen de la disolución como 970 g de H2SO4 en una disolución de 2.1 L. La calculadora de molaridad te dirá que la molaridad de tu ácido es 4.71331 M, siendo la concentración másica 0.461905 g/ml.
Concentración molar
Cuando miras a tu alrededor, incluso si estás sentado en casa, notarás muchos objetos diferentes. La mayoría de estos materiales no son puros. De hecho, son mezclas.
Las mezclas están formadas por un conjunto de compuestos diferentes. En ocasiones, la cantidad de elementos puede ser bastante alta, o a veces bastante baja, pero siempre que haya más de un elemento en un objeto, se trata de una mezcla. Un vaso de jugo de naranja, una taza de té, detergentes en el baño, o leche; todas estas sustancias son mezclas.
Sin embargo, las mezclas no se limitan solo a líquidos, los sólidos y los gases también pueden ser mezclas; incluso los organismos biológicos son mezclas muy complejas de moléculas, gases y iones disueltos en agua.
En química, hay dos tipos de mezclas:
-
Mezclas homogéneas. Los componentes están uniformemente distribuidos en toda la mezcla, y solo se observa una fase de la materia. También se conocen como soluciones y pueden presentarse en estado sólido, líquido o gaseoso. No es posible separar simplemente los componentes de la mezcla, pero ninguno de los componentes ha experimentado un cambio químico. Ejemplos: agua azucarada, detergente para lavar platos, acero, líquido limpiaparabrisas, aire.
-
Mezclas heterogéneas. Los componentes de la mezcla no están distribuidos uniformemente y pueden tener regiones con propiedades diferentes. Diferentes muestras de la mezcla no son idénticas. En este tipo de mezcla, siempre están presentes al menos dos fases y por lo general es posible separarlas físicamente. Algunos ejemplos de este tipo de sustancias son: la sangre, el concreto, los cubos de hielo en los refrescos de cola, la pizza, el océano Pacífico.
La concentración es uno de los parámetros más conocidos e importantes para cualquiera que trabaje con sustancias o reacciones químicas. Esta mide la cantidad de una sustancia que está disuelta en un volumen determinado de solución.
Los químicos utilizan diferentes unidades para describir la concentración. Sin embargo, el término molaridad, también conocido como concentración molar, es la forma más común de expresarla. Cuando los reactivos (compuestos) se expresan en unidades de mol, se pueden escribir con números enteros en las reacciones químicas. Esto facilita trabajar con sus cantidades. Pero primero, veamos más de cerca qué es el mol, para luego poder entender qué es la molaridad.
Definición de mol
El mol es la unidad de medida del Sistema Internacional (SI) para la cantidad de sustancia. La definición actual fue adoptada en 1971 y se basa en el carbono-12. Dice lo siguiente:
“El mol es la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos hay en 0.012 kilogramos de carbono-12; su símbolo es “mol”. Cuando se utiliza el mol, las entidades elementales deben especificarse y pueden ser átomos, moléculas, iones, electrones, otras partículas o grupos específicos de tales partículas”
De esto se deduce que la masa molar del carbono-12 es exactamente 12 gramos por mol, M(12C) = 12 g/mol. La palabra “sustancia” en la definición debería especificar (ser reemplazada por el nombre de) la sustancia de interés en una aplicación particular, por ejemplo, la cantidad de cloruro de hidrógeno (HCl) o la cantidad de dióxido de carbono (CO2). Es crucial dar siempre una especificación precisa de la entidad implicada (como se indica en la segunda parte de la definición del mol). Esto debe hacerse proporcionando la fórmula química empírica del compuesto implicado.
Según las convenciones más recientes (en vigor a partir del 20 de mayo de 2019), la definición de mol es que un mol es la cantidad de una sustancia química que contiene exactamente 6.02214076 × 1023 partículas, como átomos, moléculas, iones, etc. Ese número se conoce como la constante de Avogadro. Su símbolo es NA o L. Utilizar el número de Avogadro 🇺🇸 proporciona una forma cómoda de considerar el peso de la sustancia y el rendimiento teórico de las reacciones químicas. Los moles te permiten leer directamente el peso de la tabla periódica (por ejemplo, 1 mol de N2 es 28 g o 1 mol de NaCl es 58.5 g).
Podemos vincular el número de entidades X en una muestra específica N(X), con los moles de X en la misma muestra n(X), con la relación: n(X) = N(X)/NA. N(X) es adimensional, y n(X) tiene la unidad SI, el mol.
¿Qué es la molaridad?
Para que no te confundas con términos químicos similares, es importante recordar que molaridad y concentración molar (M) son sinónimos. La molaridad representa la concentración de una solución. Se define como el número de moles de una sustancia o soluto, disueltos por litro de solución (¡no por litro de disolvente!).
concentración = número de moles / volumen
Fórmula de molaridad
La siguiente ecuación te permite hallar la molaridad de una solución:
molaridad = concentración / masa molar
La concentración indica la concentración másica de la solución, expresada en unidades de densidad (normalmente g/l o g/ml).
La masa molar es la masa de 1 mol del soluto. Se expresa en gramos por mol. Es una propiedad constante de cada sustancia; por ejemplo, la masa molar del agua es aproximadamente igual a 18 g/mol.
Nuestra calculadora también puede hallar la masa de sustancia que necesitas añadir a tu solución para obtener una concentración molar deseada, según la fórmula:
masa / volumen = concentración = molaridad × masa molar
donde masa es la masa del soluto (sustancia) en gramos, y volumen es el volumen total de la solución en litros.
🔎 La molaridad tiene muchas aplicaciones. Una de ellas es calcular la dilución de una solución. Aprende más con la calculadora de dilución de soluciones 🇺🇸.
Unidades de molaridad
Las unidades de concentración molar son moles por decímetro cúbico. Se denotan como mol/dm3, así como M (pronunciado “molar”). La concentración molar del soluto a veces se abrevia poniendo entre corchetes la fórmula química del soluto, por ejemplo, la concentración de aniones hidróxido puede escribirse como [OH-]. En muchos libros o artículos antiguos, puedes encontrar diferentes unidades de soluciones molares como moles por litro (mol/l). Recuerda que un decímetro cúbico equivale a un litro, por lo que estas dos notaciones expresan los mismos valores numéricos.
Antiguamente, los químicos solían dar las concentraciones como el peso del soluto/volumen. Hoy en día, dado que el mol se ha convertido en la forma más común de indicar la cantidad de una sustancia química, se suele utilizar la molaridad en su lugar.
Ten en cuenta que molaridad puede confundirse a menudo con el término molalidad. La molalidad suele escribirse con m minúscula, mientras que la molaridad (lo mencionado anteriormente) con M mayúscula. Explicamos la diferencia entre ambos más adelante.
Cómo calcular la molaridad
- Elige tu sustancia. Supongamos que es el ácido clorhídrico (HCl).
- Halla la masa molar de tu sustancia. Para el ácido clorhídrico, es igual a 36.46 g/mol.
- Decide la concentración másica de tu sustancia. Puedes introducirla directamente o rellenar las casillas de masa de la sustancia y volumen de la solución. Supongamos que tienes 5 g de HCl en una solución de 1.2 litros.
- Convierte las expresiones anteriores para obtener una fórmula de molaridad. Como
masa / volumen = molaridad × masa molar, entoncesmasa / (volumen × masa molar) = molaridad. - Sustituye los valores conocidos para calcular la molaridad:
molaridad = 5 / (1.2 × 36.46) = 0.114 mol/l = 0.114 M. - También puedes utilizar esta calculadora de molaridad para hallar la concentración másica o la masa molar. Simplemente, introduce los valores restantes y verás cómo hace todo el trabajo por ti.
Molaridad vs. molalidad
Consideremos las diferencias entre estos dos conceptos químicos de nombre similar: molaridad y molalidad. Esperamos que después de leer este párrafo no te queden dudas sobre este tema.
Ambos términos se utilizan para expresar la concentración de una solución, pero existe una diferencia significativa entre ellos. Mientras que la molaridad describe la cantidad de sustancia por unidad de volumen de solución, la molalidad define la concentración como la cantidad de sustancia por unidad de masa del disolvente. En otras palabras, la molalidad es el número de moles de soluto (materia disuelta) por kilogramo de disolvente (en el que está disuelto el soluto).
Es posible convertir de molaridad a molalidad y viceversa. Para hacer esta conversión, utiliza la siguiente fórmula:
molaridad = (molalidad × densidad de masa de la solución) / (1 + (molalidad × masa molar del soluto))
En esta tabla molaridad vs. molalidad, puedes encontrar todas las diferencias principales entre estos dos términos:
Molaridad | Molalidad | |
|---|---|---|
Definición | Cantidad de sustancia (en moles) dividida por el volumen (en litros) de la solución. | Cantidad de sustancia (en moles) dividida por la masa (en kg) del disolvente. |
Símbolo | M | m o b |
Unidad | mol/L | mol/kg |
Temperatura y presión | Dependiente | Independiente |
Uso | Más popular, práctico de utilizar en el laboratorio, más rápido y sencillo. | Preciso pero poco usado. |
Si quieres profundizar en este tema, no dudes en consultar nuestro artículo Molaridad vs. molalidad: entendiendo las diferencias clave 🇺🇸.
Solución molar – ejemplos
Como ya sabes, las mezclas y soluciones siempre nos rodean, y forman parte permanente del entorno. En la siguiente tabla encontrarás la lista de órdenes de magnitud de la concentración molar, con ejemplos tomados del entorno natural.
Molaridad | Prefijo SI | Valor | Item |
|---|---|---|---|
10-15 | fM | 2 fM | Bacterias en agua de mar superficial (1×109/L) |
10-14 | – | 50 a 100 fM | Oro en agua de mar |
10-12 | pM | 7.51 a 9.80 pM | Rango normal de los eritrocitos en sangre en un varón adulto |
10-7 | – | 101 nM | Iones hidronio e hidróxido en agua pura a 25 °C |
10-4 | – | 180 a 480 µM | Intervalo normal de ácido úrico en sangre |
10-3 | mM | 7.8 mM | Límite superior de glucosa en sangre saludable 2 horas después de comer |
10-2 | cM | 44.6 mM | Gas ideal puro a 0 °C y 101.325 kPa |
10-1 | dM | 140 mM | Iones de sodio en el plasma sanguíneo |
102 | hM | 118.8 M | Osmio puro a 20 °C (22.587 g/cm3) |
104 | myM | 24 kM | Helio en el núcleo solar (150 g/cm3 × 65 %) |
Determinar la concentración molar por valoración química
La valoración, también conocida como titulación o análisis volumétrico, es una técnica con la que puedes encontrar la concentración de una solución desconocida, basándote en su reacción química con una solución de concentración conocida. Este proceso se basa en añadir el valorante (con una concentración y volumen conocidos) a una cantidad conocida de la solución desconocida (el analito) hasta que se complete la reacción. A continuación, puedes determinar la concentración del analito midiendo el volumen de valorante utilizado.
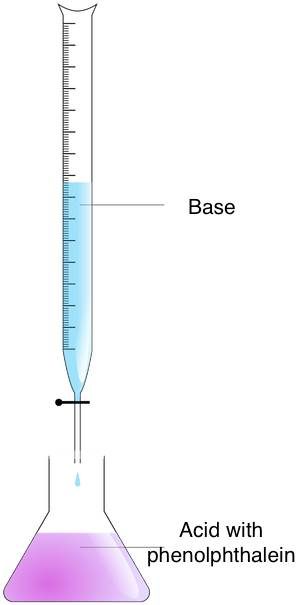
Sigue estos pasos para determinar la molaridad de una solución desconocida utilizando el método de valoración:
- Prepara las soluciones: pon el analito en un matraz Erlenmeyer y el valorante en una bureta.
- Mezcla las soluciones: añade el valorante al analito hasta alcanzar el punto final. Puedes identificar este momento observando el cambio de color, usando un indicador ácido-base. Si has utilizado fenolftaleína, notarás un cambio de color de rosa a incoloro.
- Calcula la molaridad. Emplea la fórmula de valoración. Si la relación valorante/analito es 1:1, usa la ecuación:
molaridad ácido × volumen ácido = molaridad de base × volumen de base.
En caso de relaciones distintas a 1:1, deberás ajustar la fórmula.
🙋 Aprende a calcular valoraciones con nuestra calculadora de valoración.
Ejemplo: Se necesitan 35 ml de ácido HCl a 1.25 M para valorar una solución de 25 ml de NaOH. En ese caso, puedes utilizar la fórmula 1:1 porque un mol de HCl reacciona con un mol de NaOH. A continuación, multiplica la molaridad del ácido por el volumen del ácido, 1.25 × 35 = 43.75 y el resultado, por el volumen de la base. La molaridad de la base es igual a 43.75 / 25 = 1.75 M.
🔎 Asegúrate de consultar nuestra calculadora de aligación 🇺🇸 si te interesa determinar cómo obtener distintas concentraciones de una solución.
Creación de la calculadora de molaridad
Puedes comprender la magnitud de la importancia que tiene la calculadora de molaridad porque dos de nuestras mentes más brillantes colaboraron para dar vida a esta práctica herramienta.
La trayectoria profesional y personal de Bogna Szyk es un testimonio de su polifacético talento y dedicación. Su amor por el desarrollo de herramientas prácticas, desde calculadoras a bases de datos Notion, demuestra su competencia técnica y su deseo de compartir conocimientos y herramientas para la mejora de los demás.
Filip Derma es una figura destacada y confiable en los campos de la ingeniería biomédica y eléctrica. Su disposición a abordar distintos temas refuerza aún más su versatilidad y su interés por enfrentarse a desafíos diversos, lo que demuestra una notable curiosidad intelectual y capacidad de adaptación.
Filip y Bogna colaboraron en la creación de esta herramienta, al darse cuenta de que los cálculos de molaridad podían resultar tediosos y que disponer de una calculadora de molaridad sería una útil ayuda didáctica, que ayudaría a los estudiantes a asimilar los conceptos más rápidamente y a aplicarlos en situaciones prácticas sin confundirse con la aritmética.
Nos aseguramos de que nuestras herramientas te den la respuesta correcta y dedicamos mucha investigación y esfuerzo a garantizar que nuestros usuarios reciban información auténtica, que puedan aplicar en situaciones educativas y prácticas. Para saber más sobre nuestro compromiso con la calidad, consulta nuestra página de Políticas editoriales 🇺🇸.
Preguntas frecuentes
¿Cómo calculo el pH a partir de la molaridad?
- Calcula la concentración del componente ácido/alcalino de tu solución.
- Calcula la concentración de H+ u OH- en tu solución si esta es ácida o alcalina, respectivamente.
- Calcula -log[H+] para soluciones ácidas. El resultado es el pH.
- Para las soluciones alcalinas, halla el -log[OH-] y réstalo de 14.
¿Cómo se prepara una solución molar?
- Halla el peso molecular de la sustancia de la que te gustaría hacer una solución molar en g/mol.
- Multiplica el peso molecular de la sustancia por el número de moles que deseas tener, que en este caso es 1.
- Pesa los gramos obtenidos en el paso 2 de tu sustancia y colócalos en un recipiente.
- Mide 1 litro del disolvente que hayas elegido y añádelo al mismo recipiente. Ahora tienes una solución molar.
¿Qué es el volumen molar?
El volumen molar es el volumen que ocupa un mol de una sustancia a una temperatura y presión determinadas. Se obtiene dividiendo la masa molar por la densidad de la sustancia a dicha temperatura y presión.
¿Cómo encuentro los moles a partir de la molaridad?
- Halla la molaridad y el volumen de tu solución.
- Asegúrate de que las unidades para el volumen son las mismas que para la parte del volumen de la molaridad (por ejemplo, mL y mol/mL).
- Multiplica el volumen por la molaridad. Este es el número de moles presentes.
¿Es lo mismo molaridad que concentración?
La molaridad no es lo mismo que la concentración, aunque son muy similares. La concentración es una medida de cuántos moles de una sustancia hay disueltos en una cantidad de líquido, y puede tener cualquier unidad de volumen. La molaridad es un tipo de concentración, específicamente moles por litro de solución.
¿Cuál es la molaridad del agua?
El agua tiene una molaridad de 55.5 M. 1 litro de agua pesa 1000 g y, como la molaridad es el número de moles por litro, hallar la molaridad del agua es lo mismo que hallar el número de moles de agua en 1000 g. Por tanto, dividimos el peso por la masa molar para obtener los moles, 1000 / 18.02 = 55.5 M.
¿Por qué utilizamos la molaridad?
La molaridad es una medida útil para hablar de concentración. Dado que la concentración abarca una amplia gama de tamaños de unidades, desde nanogramos por mililitro hasta toneladas por galón, resulta más conveniente contar con una métrica conocida para una comparación rápida de concentraciones sin necesidad de realizar conversiones. Esta métrica es la molaridad (M), que se expresa en moles por litro.