Calculadora de pH
Com a calculadora de pH da Omni, você pode determinar o pH de uma solução usando diferentes métodos. Ela pode converter pH em H+, bem como calcular pH a partir da constante de ionização e da concentração. O valor do pH é um fator essencial na química, na medicina e na vida cotidiana. Leia o texto abaixo para descobrir o que é a escala de pH e a fórmula de pH. No final, também explicaremos como calcular o pH de forma simples e fácil com o nosso passo a passo.
Nossa calculadora pode pedir a você a concentração da solução. Se não souber, você pode calculá-la usando a calculadora de concentração da Omni. Você também pode usar a calculadora da diluição de solução 🇺🇸 para calcular a concentração de íons em uma solução diluída.
Como usar a calculadora de pH
Uma calculadora de pH é uma ferramenta educacional inestimável, que ajuda tanto alunos quanto professores. Então, vamos nos aprofundar e ver como essa calculadora de pH pode simplificar sua vida em algumas etapas simples.
A primeira coisa que você deve decidir é como calcular o pH. Abordaremos as etapas envolvidas em cada opção:
**A partir da concentração de um ácido
-
Você recebe uma lista de alguns ácidos comuns. Você deve escolher um deles.
-
Em seguida, digite a concentração em unidades molares.
-
A ferramenta determinará imediatamente o pH e a concentração de íons hidrogênio.
-
Se você não conseguir encontrar seu ácido na lista de opções, escolha a opção Personalizado no menu da calculadora.
- Agora, você deve inserir o valor da constante de acidez (Ka) do seu ácido junto com a concentração.
-
A ferramenta calculará os valores de pH e H+ baseados em informações fornecidas.
**A partir da concentração de uma base
-
Para calcular o pH de uma base, você deve fazer o mesmo que para o ácido mencionado acima.
-
A única diferença é que, quando não encontrar a base de sua escolha na lista de opções e optar por inserir uma base personalizada, você digitará a constante de acidez (Kb) de uma base em vez de Ka.
-
A ferramenta determinará os valores de pH e H+ instantaneamente.
**A partir da massa e do volume de um ácido
-
Escolha o ácido de sua preferência na lista de 22 ácidos comuns.
-
Digite o peso do composto sólido. A unidade padrão é gramas, mas você pode selecionar outra unidade de massa da lista de acordo com sua necessidade. Certifique-se de alterar a unidade antes de inserir o valor; caso contrário, você só alterará a entrada para a unidade selecionada posteriormente.
-
Por fim, insira o volume total da solução.
-
O resultado é exibido como pH e H+.
-
Você também tem a opção de escolher personalizado se o seu ácido não estiver na lista.
- A entrada adicional necessária nesse caso é a constante de acidez do ácido Ka.
-
O pH e o H+ são calculados com base nas informações fornecidas.
A partir da massa e do volume de uma base:
- Nessa situação, o cálculo do pH para a base é o mesmo que para o ácido, conforme mencionado acima.
- A única exceção é que todos os dados que você inserir serão para a sua base desejada.
A partir da concentração de íons:
-
o pH pode ser calculado a partir da concentração de íons usando qualquer uma das três variáveis.
a. Concentração de íons hidrogênio [H+];
b. Valor de pOH; e
c. Concentração de íons hidróxido [OH-]. -
Você pode inserir qualquer um deles, e o restante será calculado, juntamente com o resultado: o valor de pH.
Para os primeiros quatro métodos, clique na seção "números relacionados" para mostrar o valor pOH, a concentração de aniôn hidróxido [OH-] e o pKa.
A escala de pH
A escala de pH (pH) é uma escala numérica usada para definir o grau de acidez ou basicidade de uma solução aquosa. Geralmente varia entre 0 e 14, mas pode ir além desses valores se for suficientemente ácida/básica. O valor do pH é logarítmico e está inversamente relacionado à concentração de íons de hidrogênio em uma solução. A fórmula pH para H+ que representa essa relação é:
A solução é ácida se seu pH for menor que 7. Se o pH for maior que 7, a solução é básica (também chamada de alcalina). As soluções com pH igual a 7 são neutras.
Além da maneira matemática de determinar o pH, você também pode usar indicadores de pH. O teste de pH mais usado universalmente é o papel de tornassol. Ele muda de cor de acordo com o pH da solução na qual foi mergulhado. Essas cores geralmente inspiram escalas de pH coloridas:
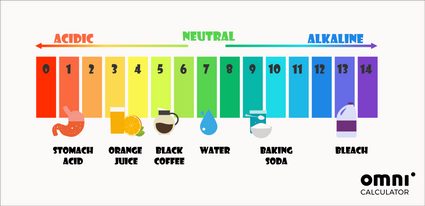
O pH em nossos corpos está próximo do neutro. Por exemplo, o pH do sangue deve estar em torno de 7,4. A única exceção é o estômago, onde os ácidos estomacais podem chegar a um pH de 1.
As moléculas podem ter um pH no qual ficam livres de cargas negativas. É isso que nossa calculadora do ponto isoelétrico 🇺🇸 determina.
Definições de um ácido e uma base
Três teorias diferentes definem ácido e base:
- Segundo a teoria de Arrhenius, em uma solução aquosa, um ácido é uma substância capaz de doar íons de hidrogênio, enquanto uma base doa íons de hidróxido.
- A teoria de Brønsted-Lowry diz que o ácido pode doar prótons, enquanto a base pode aceitá-los.
- A teoria de Lewis afirma que um ácido é algo que pode aceitar pares de elétrons. De forma análoga, uma base doa pares de elétrons.
Quanto maior for a concentração de íons de hidrogênio, menor será o pH da solução e, consequentemente, maior será sua acidez. O inverso é verdadeiro para íons de hidróxido e bases. Quanto maior a concentração de íons de hidróxido, maior o pH da solução e, consequentemente, maior a sua basicidade.
Podemos descrever a reação de um ácido, HA, na água como:
com a constante de ionização do ácido:
Uma reação química semelhante entre a base BOH e a água tem o seguinte aspecto:
A próxima equação fornece a constante de ionização da base para a fórmula acima:
Se você quiser saber mais sobre as constantes de equilíbrio químico, confira a calculadora da constante de equilíbrio ou a calculadora do quociente de reação 🇺🇸 da Omni.
Como encontrar o pH: fórmula do pH
O PH é definido como o negativo do logaritmo de base dez da concentração molar de íons de hidrogênio presentes na solução. A unidade para a concentração de íons de hidrogênio é mols por litro. Para determinar o pH, você pode usar esta fórmula de pH para H⁺:
Se você já conhece o pH, mas deseja calcular a concentração de íons, use esta equação:
Existe também uma escala de pOH, que é menos popular do que a escala de pH. pOH é o negativo do logaritmo da concentração de íons de hidróxido:
ou:
o pH e o pOH estão relacionados um ao outro por essa equação de pOH e pH:
Como calcular o pH? — Solução passo a passo
Aqui está o passo a passo que você precisa seguir para calcular o pH de uma solução:
-
Vamos supor que a concentração de íons de hidrogênio seja igual a 0,0001 mol/L.
-
Calcule o pH usando a fórmula de pH para H⁺:
- Agora, você também pode determinar facilmente o pOH e a concentração de íons de hidróxido usando as fórmulas:
É claro que você não precisa fazer todos esses cálculos manualmente! Escolha a opção para determinar o pH com a concentração de íons na calculadora e digite qualquer um desses quatro valores! Depois, veja como a ferramenta faz todo o trabalho para você!
- Como alternativa, você pode encontrar um produto químico nas listas (de ácidos ou bases). Digamos que você queira saber como encontrar o pH do ácido fórmico
HCOOH. SeuKaé0,00018. - Escolha a concentração do produto químico. Vamos supor que seja igual a
0,1 mol/L. - Para encontrar uma concentração de íons H⁺, você precisa...:
onde:
Aqui, é a concentração molar da solução, e é igual à concentração molar de H⁺.
Para 0,1 M de HCOOH:
Agora você sabe como calcular o pH usando as equações de pH. Se você achar que esses cálculos consomem muito tempo, fique à vontade para usar nossa calculadora de pH. Selecione o produto químico e sua concentração e veja a calculadora fazer todo o trabalho para você.
A mente por trás da calculadora de pH
Bioquímicos, cientistas ambientais e cientistas de materiais frequentemente precisam calcular ou ajustar os valores de pH para suas pesquisas. Percebendo essa necessidade, pensei que uma calculadora de pH aceleraria esses processos, permitindo a realização de experimentos eficientes.
Eu sou Julia Żuławińska, o cérebro por trás dessa eficiente calculadora de pH, e me destaco na comunidade científica, particularmente em Biofísica e Biotecnologia Molecular. Meu trabalho incorpora uma interseção de ciência e sustentabilidade, ressaltando significativamente meu papel como pesquisadora com visão de futuro, pronta para contribuir com a conservação ecológica e a inovação biotecnológica.
É possível determinar as fontes de poluição e a saúde dos ecossistemas monitorando o pH de corpos d'água naturais. Os cientistas ambientais poderiam usar calculadoras de pH para avaliar a qualidade da água instantaneamente.
Garantimos que nossas ferramentas sejam baseadas em informações autênticas e pesquisas adequadas. Depois que um especialista cria a calculadora, outro especialista da área a revisa minuciosamente. Em seguida, um falante nativo do idioma revisa o conteúdo, garantindo maior refinamento; só então, a ferramenta é liberada para nossos usuários. Para saber mais sobre nosso compromisso com a qualidade, consulte nossa página de Políticas Editoriais 🇺🇸.
Perguntas frequentes
O que é pH?
O pH mede a concentração de íons de hidrogênio positivos em uma solução. Essa quantidade está correlacionada à acidez de uma solução: quanto maior a concentração de íons de hidrogênio, menor o pH. Essa correlação deriva da tendência de substâncias ácidas causarem a dissociação da água: quanto maior a dissociação, maior a acidez.
Como calcular o pH de uma solução?
Para calcular o pH de uma solução:
-
Meça a concentração de íons de hidrogênio na solução. Alternativamente, você pode medir a atividade da mesma. Você pode chamá-la de
[H+]. -
Calcule o logaritmo de base 10 dessa quantidade:
log10([H+]). -
Tome o inverso aditivo dessa quantidade. O pH é dado por:
pH = - log10([H+])
Qual é a diferença entre pH e pOH?
O pOH é uma medida semelhante ao pH e está correlacionado à concentração de íons de hidróxido em uma solução. A fórmula para o pOH é:
pOH = -log10([OH-])
Em condições específicas (soluções aquosas à temperatura ambiente), podemos definir uma relação útil entre o pH e o pOH:
pH = 14 - pOH
Quais são alguns exemplos de pH?
Aqui estão alguns exemplos de pH:
-
O pH da água pura é
7, sendo este o ponto médio da escala de pH. -
O pH do nosso estômago varia de
1,5a3,5: nosso estômago é bastante ácido! -
O ácido da bateria do seu carro tem um pH de aproximadamente
0,5: não coloque suas mãos lá! -
Produtos domésticos como limpadores de ralo são bases fortes: alguns podem atingir um pH de
14!