Za pomocą tego kalkulatora pH określisz pH roztworu na kilka sposobów. Może on przeliczać pH na jony H+, jak również obliczyć pH ze stałej jonizacji i stężenia. Wartość pH jest istotnym czynnikiem w chemii, medycynie i życiu codziennym. Przeczytaj poniższy tekst, aby dowiedzieć się, czym jest skala pH i jak wygląda wzór na pH. Na koniec wyjaśnimy również, jak krok po kroku obliczyć pH.
Nasz kalkulator może zapytać cię o stężenie roztworu. Jeśli go nie znasz, możesz je obliczyć używając naszego kalkulatora stężenia. Możesz również użyć kalkulatora rozcieńczenia roztworu 🇺🇸, aby obliczyć stężenie jonów w rozcieńczonym roztworze.
Jak korzystać z kalkulatora pH
Kalkulator pH jest nieocenionym narzędziem edukacyjnym, pomagającym zarówno uczniom, jak i nauczycielom. Podrążmy trochę i zobaczmy, jak ten kalkulator pH może uprościć twoje życie w kilku prostych krokach.
Pierwszą rzeczą, którą musisz zdecydować, jest jak obliczyć pH. Omówimy kroki związane z każdą opcją:
Od stężenia kwasu:
-
Otrzymujesz listę niektórych popularnych kwasów. Wybierz jeden z nich.
-
Następnie podaj stężenie w jednostkach molowych.
-
Narzędzie natychmiast określi pH i stężenie jonów wodorowych.
-
Jeśli nie możesz znaleźć swojego kwasu na liście opcji, wybierz Własne.
- Teraz musisz wprowadzić wartość stałej jonizacji (Ka) kwasu wraz ze stężeniem.
-
Narzędzie obliczy wartości pH i H+ na podstawie podanych informacji.
Na podstawie stężenia zasady:
-
Obliczanie pH zasady jest takie samo jak w przypadku kwasu wspomnianego powyżej.
-
Jedyną różnicą jest to, że jeśli nie znajdziesz wybranej zasady na liście opcji i zdecydujesz się wprowadzić własną zasadę, zamiast Ka wprowadzisz stałą jonizacji (Kb) zasady.
-
Narzędzie natychmiast określi wartości pH i H+.
Na podstawie masy i objętości kwasu:
-
Wybierz kwas z listy 22 popularnych kwasów.
-
Wprowadź masę związku chemicznego. Domyślną jednostką są gramy, ale możesz wybrać inną jednostkę masy z listy. (Upewnij się, że zmienisz jednostkę przed wprowadzeniem wartości; w przeciwnym razie dane wejściowe zostaną zmienione tylko na później wybraną jednostkę).
-
Na koniec wprowadź całkowitą objętość roztworu.
-
Wynik jest wyświetlany jako pH i H+.
-
Możesz również wybrać Własne, jeśli twój kwas nie znajduje się na liście.
- W takim przypadku wymagane jest wprowadzenie stałej jonizacji Ka.
-
Wartości pH i H+ są obliczane na podstawie podanych informacji.
Na podstawie masy i objętości zasady:
- W tej sytuacji obliczenie pH dla zasady jest takie samo jak dla kwasu, jak wspomniano powyżej.
- Jedynym wyjątkiem jest to, że wszystkie dane, które wprowadzisz, będą dotyczyły zasady.
Od stężenia jonów:
-
pH można obliczyć na podstawie stężenia jonów przy użyciu jednej z trzech zmiennych.
a. Stężenie jonów wodorowych [H+];
b. wartość pH; oraz
c. Stężenie jonów wodorotlenkowych [OH-]. -
Możesz wprowadzić dowolną z nich, a pozostałe zostaną obliczone wraz z wynikiem: wartość pH.
Aby wyświetlić wartość pOH, stężenie jonów wodorotlenkowych [OH-] i pKa rozwiń sekcję Wyniki powiązane w naszym kalkulatorze!
Skala pH
Skala pH (pH) jest skalą liczbową używaną do określenia, jak kwaśny lub zasadowy jest roztwór wodny. Zazwyczaj mieści się w zakresie od 0 do 14, ale może wykraczać poza te wartości, jeśli jest wystarczająco kwaśny/zasadowy. Wartość pH jest logarytmicznie i odwrotnie związana ze stężeniem jonów wodorowych (H+) w roztworze. Wzór przeliczający pH na H+, który przedstawia tę zależność to:
Roztwór jest kwaśny, jeśli jego pH jest mniejsze niż 7. Jeśli pH jest wyższe, roztwór jest zasadowy (zwany również alkalicznym). Roztwory o pH równym 7 są obojętne.
Oprócz matematycznego sposobu określania pH można również skorzystać ze wskaźników pH. Najbardziej powszechnie stosowanym testem pH jest papierek lakmusowy. Zmienia on swój kolor w zależności od pH roztworu, w którym został zanurzony. Kolory te często są inspiracją dla kolorowych skal pH:
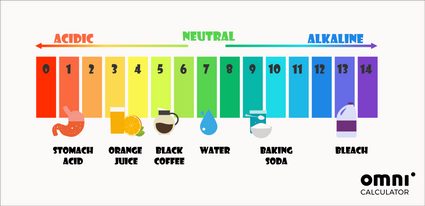
W naszym organizmie pH jest zbliżone do neutralnego. Dla przykładu pH krwi powinno wynosić około 7,4. Jedynym wyjątkiem jest żołądek, gdzie kwasy żołądkowe mogą nawet osiągnąć pH równe 1.
Cząsteczki mogą mieć pH, przy którym są pozbawione ładunku ujemnego. To właśnie określa nasz kalkulator punktu izoelektrycznego 🇺🇸.
Definicje kwasu i zasady
Trzy różne teorie definiują kwas i zasadę:
- Według teorii Arrheniusa kwas w roztworze wodnym to substancja zdolna do oddawania jonów wodorowych, podczas gdy zasada oddaje jony wodorotlenkowe.
- Teoria Brønsteda-Lowry'ego mówi, że kwas może oddać protony, podczas gdy zasada może je przyjąć.
- Teoria Lewisa mówi, że kwas może przyjmować pary elektronów. Analogicznie, zasada oddaje pary elektronowe.
Im wyższe stężenie jonów wodorowych pochodzących z cząsteczek kwasu, tym niższe pH roztworu, a w efekcie wyższa jego kwasowość. Odwrotnie jest w przypadku jonów wodorotlenkowych i zasad. Im wyższe stężenie jonów wodorotlenkowych pochodzących od cząsteczek zasad, tym wyższe pH roztworu, a w rezultacie wyższa jego zasadowość.
Reakcję kwasu, HA, w wodzie możemy opisać jako:
ze stałą jonizacji:
Podobna reakcja chemiczna między zasadą BOH, a wodą wygląda tak:
Kolejne równanie opisuje stałą jonizacji dla zasady dla równania powyżej:
Jeśli chcesz dowiedzieć się więcej o stałych równowagi chemicznej, sprawdź kalkulator stałej równowagi lub kalkulator ilorazu reakcji 🇺🇸.
Jak obliczyć pH — równanie pH
pH definiuje się jako ujemny logarytm dziesiętny ze stężenia molowego jonów wodorowych obecnych w roztworze. Jednostką stężenia jonów wodorowych są mole na litr. Aby określić pH, można użyć tego wzoru pH do H⁺:
Jeśli znasz już pH, ale chcesz obliczyć stężenie jonów, użyj tego przekształconego równania pH:
Istnieje również skala pOH — która jest mniej popularna od skali pH. pOH to ujemna wartość logarytmu stężenia jonów wodorotlenkowych:
lub:
pH i pOH są ze sobą powiązane równaniem:
Jak obliczyć pH? - rozwiązanie krok po kroku
Oto kroki do obliczenia pH roztworu:
-
Załóżmy, że stężenie jonów wodorowych jest równe 0,0001 mol/L.
-
Oblicz pH, korzystając ze wzoru pH na H⁺:
- Teraz możesz też łatwo wyznaczyć pOH i stężenie jonów wodorotlenkowych korzystając ze wzorów:
Oczywiście nie musisz wykonywać wszystkich tych obliczeń ręcznie! Wybierz w kalkulatorze opcję określania pH za pomocą stężenia jonów i wpisz dowolną z tych czterech wartości. Nasze narzędzie wykona całą pracę za ciebie.
- Ewentualnie możesz znaleźć substancję chemiczną na liście kwasów lub zasad. Powiedzmy, że chcesz wiedzieć, jak obliczyć pH kwasu mrówkowego -
HCOOH. JegoKawynosi0,00018,. - Wybierz stężenie związku chemicznego. Załóżmy, że jest ono równe
0,1 mol/L. - Aby znaleźć stężenie jonów H⁺, należy..:
gdzie:
Tutaj jest stężeniem molowym roztworu, a $$x%$ jest równe stężeniu molowemu H⁺.
Dla 0,1 M HCOOH:
Teraz już wiesz, jak obliczyć pH za pomocą równań pH. Jeśli te obliczenia są dla ciebie zbyt czasochłonne, skorzystaj z naszego kalkulatora pH. Wybierz substancję chemiczną, jej stężenie i obserwuj, jak kalkulator wykonuje całą pracę za ciebie.
Umysł stojący za kalkulatorem pH
Biochemicy, naukowcy zajmujący się ochroną środowiska i materiałoznawcy często muszą obliczać lub dostosowywać wartości pH do swoich badań. Zdając sobie sprawę z tej potrzeby, stwierdziłam, że kalkulator pH przyspieszy te procesy, umożliwiając efektywne eksperymentowanie.
Nazywam się Julia Żuławińska, jestem autorem tego wydajnego kalkulatora pH i cieszę się szacunkiem w społeczności naukowej, szczególnie w dziedzinie biofizyki i biotechnologii molekularnej. Moja praca uosabia skrzyżowanie nauki i zrównoważonego rozwoju, znacząco podkreślając moją rolę jako przyszłościowo myślącego badacza, który może przyczynić się do ochrony środowiska i innowacji biotechnologicznych.
Możliwe jest określenie źródeł zanieczyszczeń i stanu ekosystemów poprzez monitorowanie pH naturalnych zbiorników wodnych. Naukowcy zajmujący się ochroną środowiska mogliby używać kalkulatorów pH do natychmiastowej oceny jakości wody.
Zapewniamy, że nasze narzędzia są oparte na autentycznych informacjach i odpowiednich badaniach. PPo stworzeniu kalkulatora przez eksperta, inny ekspert w tej dziedzinie dokładnie go sprawdza. Następnie native speaker dokonuje korekty treści, zapewniając dalsze udoskonalenia; dopiero wtedy narzędzie jest udostępniane naszym użytkownikom. Aby dowiedzieć się więcej o naszym zaangażowaniu w jakość, zapoznaj się z naszą stroną Zasady redakcyjne 🇺🇸.
FAQs
Co to jest pH?
pH mierzy stężenie dodatnich jonów wodorowych w roztworze. Wielkość ta jest skorelowana z kwasowością roztworu: im wyższe stężenie jonów wodorowych, tym niższe pH. Zależność ta wynika z tendencji substancji kwaśnej do powodowania dysocjacji wody: im większa dysocjacja, tym większa kwasowość.
Jak obliczyć pH roztworu?
Aby obliczyć pH roztworu:
- Zmierz stężenie jonów wodorowych w roztworze. Możesz też zmierzyć aktywność. Możemy ją nazwać
[H+]. - Oblicz logarytm 10 podstawy tej wielkości:
log10([H+]).
3. Zmień jej znak na minus. Wartość pH jest określona przez:
pH = - log10([H+]).
Jaka jest różnica między pH a pOH?
pOH jest podobnym pomiarem do pH i koreluje ze stężeniem jonów wodorotlenkowych w roztworze. Wzór na pOH to:
pOH = -log10([OH-]).
W określonych warunkach (roztwory wodne w temperaturze pokojowej) możemy określić przydatną zależność pomiędzy pH a pOH:
pH = 14 - pOH.
Jakie są przykłady pH?
Oto kilka przykładów pH:
- pH czystej wody wynosi
7, czyli znajduje się pośrodku skali pH. - pH naszego żołądka waha się od
1,5do3,5: nasz żołądek jest dość kwaśny. - Kwas w twoim akumulatorze samochodowym ma pH około
0,5: nie wkładaj tam rąk! - Produkty domowe, takie jak środki do czyszczenia kanalizacji są silnymi zasadami: niektóre mogą osiągnąć pH
14.