Con questo calcolatore di pH, puoi determinare il pH di una soluzione in diversi modi. Può convertire pH in H+, oltre a calcolare pH dalla costante di ionizzazione e dalla concentrazione. Il valore del pH è un fattore essenziale nella chimica, nella medicina e nella vita quotidiana. Leggi il testo qui sotto per scoprire cos'è la scala del pH e la formula del pH. Infine, ti spiegheremo anche come calcolare il pH con una semplice soluzione passo dopo passo.
Il nostro calcolatore potrebbe chiederti la concentrazione della soluzione. Se non la conosci, puoi calcolarla utilizzando il nostro calcolatore per la concentrazione. Puoi anche utilizzare il calcolatore per la diluizione della soluzione 🇺🇸 per calcolare la concentrazione di ioni in una soluzione diluita.
Come usare il calcolatore di pH
Il calcolatore di pH è un prezioso strumento educativo che aiuta sia gli studenti che gli insegnanti. Quindi, tuffiamoci e vediamo come questo calcolatore di pH può semplificarti la vita in pochi semplici passi.
La prima cosa che devi decidere è come calcolare il pH. Ti illustreremo i passaggi necessari per ciascuna opzione:
A partire dalla concentrazione di un acido:
-
Ti viene fornito un elenco di alcuni acidi comuni. Scegli uno di essi.
-
Inserisci quindi la
Concentrazionein unità molari. -
Lo strumento determinerà immediatamente il
pHe la concentrazione di idrogenioni[H⁺]. -
Se non trovi il tuo acido nell'elenco delle opzioni, scegli
Opzione personalizzata.- Ora devi inserire il valore della costante di ionizzazione dell'acido
Kainsieme alla concentrazione.
- Ora devi inserire il valore della costante di ionizzazione dell'acido
-
Lo strumento calcolerà i valori di
pHe[H⁺]in base alle informazioni fornite.
Dalla concentrazione di una base:
-
Il calcolo del pH di una base è identico a quello dell'acido di cui sopra.
-
In un'altro caso, se non trovi la base di tua scelta nell'elenco delle opzioni e hai scelto l'
Opzione personalizzata, inserirai la costante di ionizzazione della baseKbinvece di Ka. -
Lo strumento determinerà immediatamente i valori di
pHe[H⁺].
Dalla massa e dal volume di un acido:
-
Scegli l'acido che preferisci dall'elenco dei 22 acidi comuni.
-
Inserisci il
Pesodel composto solido. L'unità di misura predefinita è il grammo, ma puoi selezionare un'altra unità di misura dall'elenco in base alle tue esigenze. (Assicurati di cambiare l'unità di misura prima di inserire il valore; in caso contrario, il programma cambierà solo l'unità di misura selezionata successivamente). -
Infine, inserisci il
Volumetotale della soluzione. -
Il risultato viene visualizzato come
pHe[H⁺]. -
Hai anche la possibilità di scegliere l'
Opzione personalizzatase il tuo acido non è presente nell'elenco.- L'input aggiuntivo richiesto in questo caso è la costante di ionizzazione dell'acido
Ka.
- L'input aggiuntivo richiesto in questo caso è la costante di ionizzazione dell'acido
-
Il
pHe l'[H⁺]vengono calcolati in base alle informazioni fornite.
Dalla massa e dal volume di una base:
- In questa situazione, il calcolo del pH per la base è lo stesso di quello per l'acido, come già detto.
- L'unica eccezione è che tutti i dati inseriti saranno relativi alla base desiderata.
Dalla concentrazione di ioni:
-
Il pH può essere calcolato per mezzo della concentrazione di ioni utilizzando una delle tre variabili.
a. Concentrazione di idrogenioni
[H⁺];
b. Valore delpH; e
c. Concentrazione di ioni idrossido[OH⁻]. -
Puoi inserire uno qualsiasi di questi valori e gli altri verranno calcolati, insieme al risultato: il valore del pH.
Per i primi quattro metodi, clicca sulla sezione Numeri correlati per visualizzare il valore pOH, la concentrazione di ioni idrossido [OH-] e il pKa.
La scala del pH
La scala del pH (pH) è una scala numerica utilizzata per definire quanto è acida o basica una soluzione acquosa. Di solito oscilla tra 0 e 14, ma può andare oltre questi valori se è sufficientemente acida/basica. Il valore del pH è logaritmico e inversamente correlato alla concentrazione di ioni idrogeno in una soluzione. La formula pH in H+ che rappresenta questa relazione è:
Una soluzione è acida se il suo pH è inferiore a 7. Se il pH è superiore, la soluzione è basica (detta anche alcalina). Le soluzioni con un pH uguale a 7 sono neutre.
Oltre al metodo matematico per determinare il pH, puoi anche utilizzare degli indicatori di pH. Il test del pH più universalmente utilizzato è la cartina tornasole. Essa cambia colore in base al pH della soluzione in cui è stata immersa. Questi colori spesso ispirano scale di pH colorate:
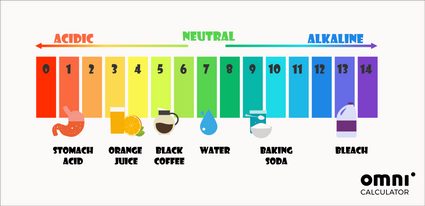
Il pH del nostro corpo è vicino alla neutralità. Ad esempio, il pH del sangue dovrebbe essere circa 7,4. L'unica eccezione è rappresentata dallo stomaco, dove gli acidi gastrici possono raggiungere un pH pari a 1.
Le molecole possono avere un pH in cui sono prive di carica negativa. Questo è ciò che determina il nostro calcolatore del punto isoelettrico 🇺🇸.
Definizioni di acido e base
Ci sono tre diverse teorie per definire gli acidi e le basi:
- Secondo la teoria di Arrhenius, in una soluzione acquosa, un acido è una sostanza in grado di donare ioni idrogeno, mentre una base dona ioni idrossido.
- la teoria di Brønsted—Lowry afferma che un acido può donare protoni mentre una base può accettarli.
- La teoria di Lewis afferma che un acido è in grado di accettare coppie di elettroni. Analogamente, una base dona coppie di elettroni.
Più alta è la concentrazione di ioni di idrogeno provenienti da molecole acide, più basso è il pH della soluzione e, di conseguenza, più alta è la sua acidità. L'inverso è vero per gli ioni idrossido e le basi. Più alta è la concentrazione di ioni idrossido provenienti da molecole di base, più alto è il pH della soluzione e, di conseguenza, la sua basicità.
Possiamo descrivere la reazione di un acido, HA, in acqua come:
con la costante di ionizzazione dell'acido:
Una reazione chimica simile tra la base BOH e l'acqua si presenta in questo modo:
L'equazione successiva fornisce la costante di ionizzazione di base per la formula precedente:
Se vuoi saperne di più sulle costanti di equilibrio chimico, consulta il calcolatore di costanti di equilibrio o il calcolatore di quoziente di reazione 🇺🇸.
Come trovare il pH — formula del pH
Il pH è definito come il negativo del logaritmo in base dieci della concentrazione molare di ioni idrogeno presenti nella soluzione. L'unità di misura della concentrazione di ioni idrogeno è la mole per litro. Per determinare il pH, puoi utilizzare la formula pH a H+:
Se conosci già il pH ma vuoi calcolare la concentrazione degli ioni, usa questa equazione del pH trasformata:
Esiste anche una scala pOH, in cui è meno popolare della scala del pH. pOH è il negativo del logaritmo della concentrazione di ioni idrossido:
oppure:
il pH e il pOH sono correlati tra loro da questa equazione del pOH e del pH:
Come calcolare il pH? — soluzione passo dopo passo
Ecco i passaggi per calcolare il pH di una soluzione:
-
Supponiamo che la concentrazione degli ioni idrogeno sia pari a 0,0001 mol/L.
-
Calcola il pH utilizzando la formula del pH in H⁺:
- Ora puoi anche determinare facilmente il pOH e la concentrazione di ioni idrossido utilizzando le formule:
Naturalmente, non devi svolgere tutti questi calcoli a mano! Scegli l'opzione per determinare il pH con la concentrazione di ioni nel calcolatore e inserisci uno qualsiasi di questi quattro valori! Poi, guarda come lo strumento fa tutto il lavoro per te!
- In alternativa, puoi trovare una sostanza chimica dagli elenchi (di acidi o basi). Supponiamo che tu voglia sapere come trovare il pH dell'acido formico —
HCOOH. Il suoKaè0,00018. - Scegli la concentrazione della sostanza chimica. Supponiamo che sia pari a
0,1 mol/L. - Per trovare la concentrazione di ioni H⁺, devi:
dove:
Qui è la concentrazione molare della soluzione e è uguale alla concentrazione molare di H⁺.
Per 0,1 M HCOOH:
Ora sai come calcolare il pH utilizzando le equazioni del pH. Se trovi che questi calcoli richiedano molto tempo, puoi usare il nostro calcolatore di pH. Seleziona la tua sostanza chimica e la sua concentrazione e vedrai che farà tutto il lavoro per te.
La mente dietro al calcolatore di pH
Biochimici, scienziati ambientali e scienziati dei materiali hanno spesso bisogno di calcolare o regolare i valori del pH per le loro ricerche. Avendo capito questa necessità, ho pensato che un calcolatore di pH avrebbe velocizzato questi processi, consentendo una sperimentazione efficiente.
Sono Julia Żuławińska, l'ideatrice di questo efficiente calcolatore di pH, e sono una figura esemplare nella comunità scientifica, in particolare nell'ambito della Biofisica e della Biotecnologia Molecolare. Il mio lavoro incarna l'intersezione tra scienza e sostenibilità, sottolineando in modo significativo il mio ruolo di ricercatore lungimirante pronto a contribuire alla conservazione ecologica e all'innovazione biotecnologica.
È possibile determinare le fonti di inquinamento e la salute degli ecosistemi monitorando il pH dei corpi idrici naturali. Gli scienziati ambientali potrebbero utilizzare dei calcolatori per il pH per valutare istantaneamente la qualità dell'acqua.
Ci assicuriamo che i nostri strumenti siano basati su informazioni autentiche e su ricerche adeguate. Dopo che un esperto ha creato il calcolatore, un altro esperto del settore lo revisiona accuratamente. Poi, un madrelingua corregge il contenuto, assicurando un ulteriore perfezionamento; solo allora lo strumento viene rilasciato ai nostri utenti. Per scoprire di più sul nostro impegno per la qualità, ti invitiamo a consultare la nostra pagina delle Politiche Editoriali 🇺🇸.
FAQ
Che cos'è il pH?
Il pH misura la concentrazione di ioni idrogeno positivi in una soluzione. Questa quantità è correlata all'acidità di una soluzione — maggiore è la concentrazione di ioni idrogeno, minore è il pH. Questa correlazione deriva dalla tendenza di una sostanza acida a causare la dissociazione dell'acqua — maggiore è la dissociazione, maggiore è l'acidità.
Come si calcola il pH di una soluzione?
Per calcolare il pH di una soluzione:
-
Misura la concentrazione di ioni idrogeno nella soluzione. In alternativa, puoi misurare l'attività della stessa specie. Possiamo chiamarla
[H+]. -
Calcola il logaritmo in base 10 di questa quantità:
log10([H+]). -
Prendi l'inverso additivo di questa quantità. Il pH è dato da:
pH = - log10([H+])
Qual è la differenza tra pH e pOH?
Il pOH è una misura simile al pH e si correla alla concentrazione di ioni idrossido in una soluzione. La formula del pOH è:
pOH = -log10([OH-])
In condizioni specifiche (soluzioni acquose a temperatura ambiente), possiamo definire un'utile relazione tra pH e pOH:
pH = 14 - pOH
Quali sono alcuni esempi di pH?
Ecco alcuni esempi di pH:
-
Il pH di acqua pura è
7, ovvero il punto medio della scala del pH. -
Il pH del nostro stomaco varia da
1,5a3,5: il nostro stomaco è piuttosto acido! -
L'acido della batteria della tua auto ha un pH di circa
0,5: non metterci le mani dentro! -
I prodotti per la casa come i pulitori per scarichi sono basi forti: alcuni possono raggiungere un pH di
14!