Questo calcolatore per la molarità è uno strumento per convertire la concentrazione di massa di qualsiasi soluzione in concentrazione molare (o ricalcolare i grammi per ml in moli). Puoi anche calcolare la massa di una sostanza necessaria per ottenere la molarità desiderata. Questo articolo ti fornirà la definizione di molarità e la formula della molarità.
Per comprendere l'argomento nel suo complesso, dovrai imparare la definizione di mole, leggere un paragrafo sulle unità di molarità e leggere un confronto tra due concetti fuorvianti — formula di molarità vs formula di molalità. Inoltre, abbiamo preparato per te alcuni esempi interessanti di soluzioni molari e un breve tutorial passo a passo su come calcolare la molarità di una soluzione concentrata.
Alla fine, potrai imparare la definizione di titolazione e scoprire come trovare la concentrazione molare utilizzando il processo di titolazione!
Come usare il calcolatore per la molarità
Il calcolatore per la molarità è semplice e comodo, e lo scoprirai presto. Ma sapevi quanto è importante calcolare la molarità? Per mantenere la qualità dei prodotti e la conformità alle norme di sicurezza è necessario determinare la molarità di composti chimici o additivi specifici nell'industria alimentare e delle bevande.
-
Se conosci la
Concentrazionedella soluzione, inseriscila nella quarta variabile del calcolatore. Un fatto interessante è che la concentrazione di massa è uguale alla sua densità per una sostanza pura. L'unità di misura predefinita è g/mL, grammi per millilitro, ma puoi cambiarla tra le opzioni proposte; assicurati di cambiare l'unità prima di inserire il valore. -
Successivamente, immetti la
Massa molaredella sostanza. L'unità predefinita è il grammo per mole, ma puoi cambiarla prima con altre unità comunemente utilizzate. -
A questo punto, assisti alla magia: il calcolatore determina istantaneamente la
Molarità. L'unità predefinita è molari (M). Puoi cambiarla in base alle tue esigenze dall'elenco di opzioni fornito. -
Ma cosa fare se non si dispone della concentrazione di massa della sostanza? Come si calcola la molarità? Il nostro strumento ha la risposta anche per questo. In questa situazione, lascia vuota la
Concentrazionedi massa. -
Inserisci la
Massadella sostanza in grammi o cambia l'unità di misura se necessario. -
Infine, inserisci il
Volumedella soluzione. -
Il nostro strumento è abbastanza intelligente da determinare la concentrazione di massa e la molarità in base alle informazioni che ci hai fornito.
Consideriamo un esempio: La sostanza desiderata è acido solforico e la massa molare è 98 g/mol con una concentrazione molare di 10 g/ml. Inserendo questi valori nel calcolatore, la molarità sarà 102,0408 M.
Ora, immagina di non conoscere la concentrazione di massa dell'acido. Invece, hai la massa e il volume della soluzione come 970 g di H2SO4 in una soluzione di 2,1 L. Il calcolatore per la molarità ti dirà che la molarità del tuo acido è 4,71331 M, con una concentrazione di massa molare di 0,461905 g/ml.
Concentrazione molare — un'introduzione
Quando ti guardi intorno, anche se sei seduto a casa, noterai molti oggetti diversi. La maggior parte di questi materiali non sono puri. Si tratta infatti di miscele.
Le miscele sono costituite da un insieme di composti diversi. A volte il numero di elementi può essere molto alto, altre volte molto basso, ma finché c'è più di un elemento in un oggetto, si tratta di una miscela. Il succo d'arancia nel bicchiere, una tazza di tè, i detergenti nel bagno o il latte — tutte queste sostanze sono miscele.
Le miscele non si limitano solo ai liquidi, ma anche i solidi e i gas possono essere miscele; persino gli organismi biologici sono miscele molto complesse di molecole, gas e ioni disciolti in acqua.
In chimica esistono due tipi di miscele:
-
Miscele omogenee — I componenti sono distribuiti uniformemente nella miscela e si osserva un'unica fase della materia. Sono note anche come soluzioni e possono presentarsi allo stato solido, liquido o gassoso. Non è possibile separare semplicemente i componenti della miscela, ma non si è verificato alcun cambiamento chimico in nessuno dei componenti. Esempi — acqua zuccherata, detersivo per piatti, acciaio, liquido lavavetri, aria.
-
Miscele eterogenee — I componenti della miscela non sono distribuiti uniformemente e possono avere regioni con proprietà diverse. Diversi campioni della miscela non sono identici. Nella miscela sono sempre presenti almeno due fasi e di solito è possibile separarle fisicamente. Alcuni esempi di sostanze di questo tipo — il sangue, il cemento, i cubetti di ghiaccio, la pizza e l’oceano Pacifico.
La concentrazione è uno dei parametri più noti e importanti per chiunque lavori con sostanze o reazioni chimiche. Misura la quantità di una sostanza disciolta in un determinato volume di soluzione.
I chimici utilizzano molte unità diverse per descrivere la concentrazione. Tuttavia, il termine molarità, noto anche come concentrazione molare, è il modo più comune di esprimere la concentrazione. Quando i reagenti (composti) sono espressi in unità mole, è possibile scriverli con numeri interi nelle reazioni chimiche. Questo aiuta a lavorare facilmente con le loro quantità. Per prima cosa, diamo un'occhiata più da vicino a cos'è la mole, in modo da poter passare poi a scoprire cos'è la molarità.
Definizione di mole
La mole è l'unità di misura SI per la quantità di sostanza. La definizione attuale è stata adottata nel 1971 e si basa sul carbonio-12. Dice:
"La mole è la quantità di sostanza di un sistema che contiene tante entità elementari quanti sono gli atomi in 0,012 chilogrammi di carbonio-12; il suo simbolo è "mol". Quando si usa la mole, le entità elementari devono essere specificate e possono essere atomi, molecole, ioni, elettroni, altre particelle o gruppi specifici di tali particelle."
Ne consegue che la massa molare del carbonio-12 è esattamente 12 grammi per mole, M(¹²C) = 12 g/mol. La parola "sostanza" nella definizione dovrebbe specificare (essere sostituita dal nome) la sostanza interessata in una particolare applicazione, ad esempio la quantità di cloruro (HCl) o la quantità di anidride carbonica (CO₂). È fondamentale fornire sempre una specificazione precisa dell'entità in questione (come indicato nella seconda parte della definizione di mole). A tal fine è necessario fornire la formula chimica empirica del composto in questione.
Secondo le convenzioni più recenti (in vigore dal 20 maggio 2019), la definizione di mole è che una mole è la quantità di una sostanza chimica che contiene esattamente 6,02214076 × 1023 particelle, come atomi, molecole, ioni etc. Questo numero è noto come Costante di Avogadro. Il suo simbolo è NA o L. L'utilizzo del constante di Avogadro 🇺🇸 è un modo conveniente per considerare il peso della sostanza e la resa teorica delle reazioni chimiche. Le moli ti permettono di leggere direttamente il peso dalla tavola periodica (ad esempio, 1 mole di N₂ è 28 g o 1 mole di NaCl è 58,5 g).
Possiamo collegare il numero di entità X in un determinato campione — N(X) — alle moli di X nello stesso campione — n(X), con la relazione: n(X) = N(X)/NA. N(X) è adimensionale, mentre n(X) ha l'unità SI mole.
Che cos'è la molarità?
Per non confonderti con termini chimici simili, tieni presente che molarità ha esattamente lo stesso significato di concentrazione molare (M). La molarità esprime la concentrazione di una soluzione. È definita come il numero di moli di una sostanza o soluto disciolte per litro di soluzione (non per litro di solvente!).
Concentrazione = numero di moli / volume.
Formula della molarità
La seguente equazione permette di trovare la molarità di una soluzione:
Molarità = concentrazione / massa molare.
La concentrazione indica la concentrazione di massa della soluzione, espressa in unità di densità (solitamente g/l o g/ml).
La massa molare è la massa di 1 mole di soluto. Si esprime in grammi per mole. È una proprietà costante di ogni sostanza — ad esempio, la massa molare dell'acqua è approssimativamente pari a 18 g/mol.
Il nostro calcolatore può anche trovare la massa di sostanza che devi aggiungere alla tua soluzione per ottenere la concentrazione molare desiderata, secondo la formula:
Massa / volume = concentrazione = molarità × massa molare,
dove massa è la massa del soluto (sostanza) in grammi e volume è il volume totale della soluzione in litri.
🔎 La molarità ha molte applicazioni. Una di queste è il calcolo della diluizione della soluzione. Per saperne di più consulta il calcolatore per la diluizione delle soluzioni 🇺🇸.
Unità di misura della molarità
Le unità di misura della concentrazione molare sono moli per decimetro cubo. Sono indicate come mol/dm³ e M (pronunciato "molare"). La concentrazione molare di un soluto viene talvolta abbreviata mettendo le parentesi quadre intorno alla formula chimica del soluto, ad esempio la concentrazione degli anioni idrossido può essere scritta come [OH-]. In molti libri o articoli vecchi, puoi trovare diverse unità di misura delle soluzioni molari — moli per litro (mol/l). Ricorda che un decimetro cubo equivale a un litro, quindi queste due notazioni esprimono gli stessi valori numerici.
In passato, i chimici indicavano le concentrazioni come "peso del soluto/volume". Al giorno d'oggi, dato che la mole è diventata il modo più comune di indicare la quantità di una sostanza chimica, si usa comunemente la molarità.
Si noti che la molarità può essere spesso confusa con il termine molalità. La molalità viene solitamente scritta con la lettera minuscola m, mentre la molarità (come detto sopra) con la lettera maiuscola M. Spieghiamo la differenza tra questi due termini in un paragrafo successivo.
Come si calcola la molarità?
- Scegli la tua sostanza. Supponiamo che sia l'acido cloridrico (HCl);
- Trova la massa molare della tua sostanza. Per l'acido cloridrico, è pari a 36,46 g/mol;
- Decidi la concentrazione di massa della tua sostanza. Supponiamo di avere 5 g di HCl in una soluzione di 1,2 litri;
- Converti le espressioni precedenti per ottenere una formula di molarità. Poiché:
Massa / volume = molarità massa molare, alloramassa / (volume × massa molare) = molarità; - Sostituisci i valori noti per calcolare la molarità:
Molarità = 5 / (1,2 × 36,46) = 0,114 mol/l = 0,114 M; e - Puoi utilizzare questo calcolatore per la molarità anche per trovare la concentrazione di quantità di sostanza o la massa molare. Basta digitare i valori rimanenti e vedere che fa tutto il lavoro per te.
Molarità vs molalità
Consideriamo le differenze tra questi due concetti chimici con nomi simili — molarità e molalità. Speriamo che dopo aver letto questo paragrafo non avrai più dubbi su questo argomento.
Entrambi i termini vengono utilizzati per esprimere la concentrazione di una soluzione, ma c'è una differenza significativa tra loro. Mentre la molarità descrive la quantità di sostanza per unità di volume della soluzione, la molalità definisce la concentrazione come la quantità di sostanza per unità di massa del solvente. In altre parole, la molalità è il numero di moli di soluto (materiale disciolto) per chilogrammo di solvente (in cui il soluto è disciolto).
È possibile ricalcolare dalla molarità alla molalità e viceversa. Per fare questo passaggio, usa la formula seguente:
Molarità = (molalità × densità di massa del soluto) / (1 + (molalità × massa molare del soluto)).
In questa tabella molarità vs molalità puoi trovare tutte le principali differenze tra questi due termini:
Molarità | Molalità | |
|---|---|---|
Definizione | Quantità di sostanza (in moli) divisa per il volume (in litri) della soluzione. | Quantità di sostanza (in moli) divisa per la massa (in kg) del solvente. |
Simbolo | M | m o b |
Unità | mol/L | mol/kg |
Temperatura e pressione | Dipendente | Indipendente |
Uso | Più popolare, pratico da usare in laboratorio, più veloce e più facile. | Accurato ma raramente usato. |
Se vuoi approfondire questo argomento, consulta il nostro articolo Molarità vs. Molalità: capire le differenze chiave 🇺🇸.
Soluzione molare — esempi
Come già sai, le miscele e le soluzioni ci circondano sempre e sono parte integrante dell'ambiente. Nella tabella qui sotto puoi trovare l'elenco degli ordini di grandezza della concentrazione molare, con esempi tratti dall'ambiente naturale.
Molarità | Prefisso SI | Valore | Voce |
|---|---|---|---|
10⁻¹⁵ | fM | 2 fM | Batteri in acqua marina superficiale (1 × 10⁹/L). |
10⁻¹⁴ | — | 50-100 fM | Oro in acqua marina. |
10⁻¹² | pM | 7,51-9,80 pM | Intervallo normale per gli eritrociti nel sangue di un uomo adulto. |
10⁻⁷ | — | 101 nM | Ioni idronio e idrossido in acqua pura a 25°C. |
10⁻⁴ | — | 180-480 µM | Intervallo normale per l'acido urico nel sangue. |
10⁻³ | mM | 7,8 mM | Limite superiore per la glicemia sana 2 ore dopo il pasto. |
10⁻² | cM | 44,6 mM | Gas ideale puro a 0°C e 101,325 kPa. |
10⁻¹ | dM | 140 mM | Ioni di sodio nel plasma sanguigno. |
10² | hM | 118,8 M | Osmio puro a 20°C (22,587 g/cm³). |
10⁴ | myM | 24 kM | Elio nel nucleo solare (150 g/cm³ × 65%). |
Determinazione della concentrazione molare mediante titolazione
La titolazione è una tecnica con cui è possibile trovare la concentrazione di una soluzione sconosciuta, in base alla sua reazione chimica con una soluzione a concentrazione nota. Questo processo si basa sull'aggiunta del titolante (con una concentrazione e un volume noti) a una quantità nota della soluzione sconosciuta (l'analita) fino al completamento della reazione. È quindi possibile determinare la concentrazione dell'analita misurando il volume di titolante utilizzato.
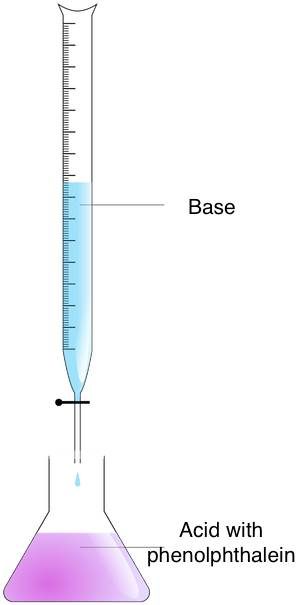
Segui questi passaggi per trovare la molarità di una soluzione sconosciuta con il metodo della titolazione:
- Prepara le concentrazioni — Metti l'analita in una beuta e il titolante in una buretta;
- Mescola le concentrazioni — Aggiungi il titolante all'analita fino a raggiungere il punto finale. Puoi individuare questo momento osservando il cambiamento di colore. A questo scopo, utilizza l'indicatore acido-base. Se hai utilizzato la fenolftaleina, noterai un cambiamento di colore da rosa a incolore; e
- Calcola la molarità — Usa la formula di titolazione. Se il rapporto tra titolante e analita è 1:1, usa l'equazione:
Molarità acida × volume dell'acido = molarità della base × volume della base.
Per rapporti diversi da 1:1, devi modificare la formula.
🙋 Scopri come calcolare le titolazioni nel calcolatore di titolazioni.
Esempio: Sono necessari 35 ml di acido HCl 1,25 M per titolare una soluzione di NaOH da 25 ml. In questo caso, puoi utilizzare la formula 1:1 perché una mole di HCl reagisce con una mole di NaOH. Quindi, moltiplica la molarità dell'acido per il volume dell'acido — 1,25 × 35 = 43,75 e il risultato per il volume della base. La molarità della base è pari a 43,75 / 25 = 1,75 M.
🔎 Assicurati di dare un'occhiata al nostro calcolatore per l'alligazione 🇺🇸 se vuoi sapere come ottenere diverse concentrazioni di una soluzione.
Invenzione del calcolatore per la molarità
Puoi capire l'importanza del calcolatore per la molarità perché due dei nostri geni hanno collaborato alla creazione di questo comodo strumento.
Il percorso professionale e personale di Bogna Szyk è una testimonianza del suo talento poliedrico e della sua dedizione. Il suo amore per lo sviluppo di strumenti pratici, dai calcolatori ai database Notion, dimostra la sua competenza tecnica e il suo desiderio di condividere conoscenze e strumenti per il miglioramento degli altri.
Filip Derma è una figura distinta e credibile nel campo dell'ingegneria biomedica ed elettrica. La sua disponibilità ad abbracciare diverse materie sottolinea ulteriormente la sua versatilità e il suo desiderio di confrontarsi con sfide diverse, dimostrando un'encomiabile curiosità intellettuale e capacità di adattamento.
Filip e Bogna hanno collaborato alla realizzazione di questo strumento, rendendosi conto che i calcoli della molarità potevano essere noiosi e che avere un calcolatore per la molarità sarebbe stato un semplice aiuto didattico, aiutando gli studenti ad afferrare i concetti più velocemente e ad applicarli in scenari pratici senza essere confusi dall'aritmetica.
Ci assicuriamo che i nostri strumenti forniscano la risposta corretta e ci impegniamo a fondo per garantire che i nostri utenti ricevano informazioni autentiche, che possano applicare in scenari educativi e pratici. Per scoprire di più sul nostro impegno per la qualità, consulta la pagina Politiche Editoriali 🇺🇸.
FAQ
Come si calcola il pH a partire dalla molarità?
- Calcola la concentrazione del componente acido/alcalino della tua soluzione;
- Calcola la concentrazione di H+ o OH- nella tua soluzione se questa è rispettivamente acida o alcalina;
- Calcola -log[H+] per le soluzioni acide. Il risultato è il pH; e
- Per le soluzioni alcaline, trova -log[OH-] e sottrailo da 14.
Come si prepara una soluzione molare?
- Trova il peso molecolare della sostanza di cui vorresti fare una soluzione molare in g/mol;
- Moltiplica il peso molecolare della sostanza per il numero di moli che desideri avere, che in questo caso è 1;
- Pesa il numero di grammi che hai calcolato al punto 2 della tua sostanza e mettilo in un contenitore; e
- Misura 1 litro del solvente che hai scelto e aggiungilo allo stesso contenitore. Ora hai una soluzione molare.
Che cos'è il volume molare?
Il volume molare è il volume occupato da una mole di una sostanza a una particolare temperatura e pressione. Si ottiene dividendo la massa molare per la densità della sostanza a quella temperatura e pressione.
Come posso trovare le moli dalla molarità?
- Trova la molarità e il volume della tua soluzione;
- Assicurati che le unità di misura del volume siano le stesse della molarità (ad esempio, mL e mol/mL); e
- Moltiplica il volume per la molarità. Questo è il numero di moli presenti.
La molarità è uguale alla concentrazione?
La molarità non è la stessa cosa della concentrazione, anche se sono molto simili. La concentrazione è una misura di quante moli di una sostanza sono disciolte in una quantità di liquido e può avere qualsiasi unità di volume. La molarità è un tipo di concentrazione, nello specifico moli per litro di soluzione.
Qual è la molarità dell'acqua?
L'acqua ha una molarità di 55,5 M. Un litro d'acqua pesa 1 000 g e, dato che la molarità è il numero di moli per litro, trovare la molarità dell'acqua equivale a trovare il numero di moli di acqua in 1 000 g. Dividiamo quindi il peso per la massa molare per ottenere le moli, 1 000 / 18,02 = 55,5 M.
Perché usiamo la molarità?
La molarità è una misura utile da utilizzare quando si parla di concentrazione. Poiché la concentrazione ha un'ampia gamma di unità di misura, dal nanogrammo per millilitro alla tonnellata per gallone, è più facile avere una metrica nota per confrontare rapidamente le concentrazioni senza dover fare conversioni. Si tratta della molarità (M), ovvero le moli per litro.