Stoffmengenkonzentration Rechner
Mit diesem Stoffmengenkonzentration-Rechner kannst du Massenkonzentration in Stoffmengenkonzentration umrechnen (oder Gramm pro ml in Mol umrechnen). Du kannst auch die benötigte Masse einer Substanz berechnen, um eine gewünschte Stoffmengenkonzentration zu erreichen. Im folgenden Text erklären wir dir die Definition der Stoffmengenkonzentration und wie man die Stoffmengenkonzentration berechnet und wie die genaue Formel für die Stoffmengenkonzentration lautet.
Um einen umfassenden Überblick über das Thema zu erhalten, schauen wir uns die Definition des Mol an, die Einheiten, die für die Stoffmengenkonzentration verwendet werden und werfen einen genaueren Blick auf die zwei irreführenden Konzepte von Molarität (veralteter Begriff für Stoffmengenkonzentration) und Molalität. Außerdem haben wir ein paar interessante Beispiele für molare Lösungen zusammengestellt und eine kurze Schritt-für-Schritt-Anleitung für die Berechnung der Stoffmengenkonzentration einer konzentrierten Lösung für dich vorbereitet.
Wir schauen uns zum Ende die Definition der Titration an und wie mithilfe dieser die Stoffmengenkonzentration ermittelt werden kann.
So verwendest du den Stoffmengenkonzentration Rechner
Der Rechner für die Stoffmengenkonzentration ist einfach und praktisch, das wirst du bald herausfinden. Aber wusstest du auch, wie wichtig die Berechnung der Stoffmengenkonzentration ist? Um die Produktqualität zu erhalten und die Sicherheitsvorschriften einzuhalten, muss die Stoffmengenkonzentration bestimmter Komponenten oder Zusatzstoffe in der Lebensmittel- und Getränkeindustrie bestimmt werden.
-
Wenn du die Konzentration der Lösung kennst, gibst du sie in die dritte Variable des Rechners ein. Eine interessante Tatsache ist, dass die Massenkonzentration bei einer reinen Substanz gleich der Dichte ist. Die voreingestellte Einheit ist g/ml, Gramm pro Milliliter, aber du kannst sie in den vorgegebenen Optionen ändern; stelle sicher, dass du die Einheit vor der Eingabe des Wertes änderst.
-
Als Nächstes gibst du die Massenkonzentration des Stoffes ein. Die Standardeinheit ist g/ml, Gramm pro Milliliter, aber du kannst sie in den vorgegebenen Optionen ändern; stelle sicher, dass du die Einheit vor der Eingabe des Wertes änderst.
-
Du siehst, wie der Rechner sofort die Stoffmengenkonzentration bestimmt. Die Standardeinheit ist mol/l. Du kannst sie in der Liste der Optionen nach deinen Bedürfnissen ändern.
-
Aber was tust du, wenn du die Massenkonzentration des Stoffes nicht gegeben hast? Wie kannst du dann die Stoffmengenkonzentration berechnen? Auch dafür hat unser Tool eine Antwort. In diesem Fall lässt du das Feld für die Massenkonzentration leer.
-
**Gib die Masse der Substanz in Gramm ein oder ändere die Einheit, falls nötig.
-
Als Letztes gibst du das Volumen der Lösung ein.
-
Unser Tool ist intelligent genug, um die Massenkonzentration und die Stoffmengenkonzentration auf Grundlage deiner Angaben zu bestimmen.
Betrachten wir ein Beispiel. Dein gewünschter Stoff ist Schwefelsäure, und die molare Masse beträgt 98 g/mol, mit einer Stoffmengenkonzentration von 10 g/ml. Wenn du diese Werte in den Rechner eingibst, erhältst du die Stoffmengenkonzentration 102,0408 mol/l.
Stell dir nun vor, du kennst die Massenkonzentration der Säure nicht. Stattdessen hast du die Masse und das Volumen der Lösung als 970 g von H2SO4 in einer 2,1 l Lösung gegeben. Der Rechner sagt dir, dass die Stoffmengenkonzentration deiner Säure 4,71331 mol/l beträgt, während die Stoffmengenkonzentration 0,461905 g/ml ist.
Molare Konzentration – eine Einführung
Überall wo du dich umschaust, auch wenn du zu Hause sitzt, wirst du viele verschiedene Gegenstände sehen. Die meisten dieser Materialien bestehen nicht nur aus einem Stoff, sie sind also nicht rein. Sie sind in Wirklichkeit Mischungen aus verschiedenen Verbindungen.
Manchmal ist die Anzahl der unterschiedlichen Elemente recht hoch, manchmal recht niedrig, aber solange mehr als ein Element in einem Gegenstand enthalten ist, handelt es sich um ein Gemisch. Orangensaft, eine Tasse Tee, das Reinigungsmittel im Bad oder Milch – all diese Stoffe sind Gemische.
Aber nicht nur Flüssigkeiten sind Gemische, auch Feststoffe und Gase können Gemische sein; sogar biologische Lebenswesen sind sehr komplexe Gemische aus Molekülen, Gasen und in Wasser gelösten Ionen.
In der Chemie gibt es zwei Arten von Gemischen:
-
Homogene Gemische – Die Reinstoffe sind gleichmäßig im Gemisch verteilt und bilden eine Phase. Sie können in festem, flüssigem oder gasförmigem Zustand vorliegen. Es ist nicht möglich, die Komponenten des Gemischs einfach so zu trennen, obwohl sich die Reinstoffe durch die Mischung chemisch nicht verändert haben. Beispiele dafür sind: Zuckerwasser, Geschirrspülmittel, Stahl, Scheibenwaschmittel, Luft.
-
Heterogene Gemische – Die Bestandteile des Gemischs sind nicht gleichmäßig verteilt und können aus Phasen mit unterschiedlichen Eigenschaften bestehen. Verschiedene Proben desselben Gemischs sind nicht identisch. In einem heterogenen Gemisch sind immer mindestend zwei Phasen vorhanden. Normalerweise ist es möglich, diese physisch voneinander zu trennen. Einige Beispiele hierfür sind: Blut, Beton, Eiswürfel in Cola, Pizza, der Pazifische Ozean.
Die Konzentration ist einer der bekanntesten und wichtigsten Parameter im Zusammenhang mit chemischen Substanzen oder Reaktionen. Sie misst, wie viel von einer Substanz in einem bestimmten Volumen einer Lösung vorhanden ist.
Chemiker benutzen viele verschiedene Einheiten, um die Konzentration zu beschreiben. Der Begriff Stoffmengenkonzentration, auch bekannt als molare Konzentration oder veraltet Molarität, ist jedoch die gebräuchlichste Art, die Konzentration auszudrücken. Wenn die Reaktanten (die chemischen Verbindungen) in mol-Einheiten ausgedrückt werden, können sie in chemischen Reaktionen mit ganzen Zahlen geschrieben werden, was den Rechnungsprozess mit diesen Mengen erleichtert. Schauen wir uns zunächst genauer an, was ein Mol ist, damit wir später den Begriff Stoffmengenkonzentration richtig verstehen können.
Definition des Mol
Die Einheit Mol ist die SI-Maßeinheit für die Menge eines Stoffes. Die aktuelle Definition wurde 1971 definiert und basiert auf den Atomen des Kohlenstoff-Nuklids 12C. Sie besagt:
„Das Mol ist die Stoffmenge eines Systems, das so viele Elementarteilchen enthält, wie Atome in 0,012 Kilogramm des Kohlenstoff-Nuklids 12C vorhanden sind; die Einheitsbezeichnung ist „mol”. Wenn das Mol verwendet wird, müssen die Elementarteilchen abgegeben sein und können Atome, Moleküle, Ionen, Elektronen, andere Teilchen oder bestimmte Gruppen solcher Teilchen sein.”
Daraus folgt, dass die molare Masse des Kohlenstoff-Nuklids 12C genau 12 Gramm pro Mol beträgt, M(¹²C) = 12 g/mol. Das Wort „Stoff“ in der Definition sollte den Stoff angeben (durch den Namen des Stoffes ersetzt werden), um den es in einer bestimmten Anwendung geht, z. B. die Menge an Chlorwasserstoff (HCl) oder die Menge an Kohlendioxid (CO₂). Es ist wichtig, die betreffenden Teilchen immer genau anzugeben (wie im zweiten Teil der Mol-Definition beschrieben), durch die empirische chemische Formel der betreffenden Verbindung.
Nach den neuesten Konventionen (gültig ab dem 20. Mai 2019) ist das Mol definiert als die Menge eines chemischen Stoffes, die genau 6,02214076 ∙ 1023 Teilchen wie Atome, Moleküle, Ionen usw. enthält. Diese Zahl ist als Avogadro-Konstante bekannt. Ihre Einheitsbezeichnung ist NA oder L. Mit der Avogadro Konstante kannst du das Gewicht eines Stoffes und die theoretische Ausbeute chemischer Reaktionen einfach berechnen. Mithilfe von Molen kannst du das Gewicht der Elemente direkt aus dem Periodensystem ablesen (z.B. 1 Mol N₂ = 28 g oder 1 Mol NaCl = 58,5 g).
Wir können die Menge X einer Teilchenart in einer bestimmten Probe – N(X) mit den Molen von X in derselben Probe – n(X) in Beziehung setzen: n(X) = N(X)/NA. N(X) ist dimensionslos, und n(X) hat die SI-Einheit Mol.
Was ist die Stoffmengenkonzentration?
Damit du nicht mit ähnlichen chemischen Begriffen verwirrt wirst, solltest du wissen, dass Stoffmengenkonzentration genau dasselbe bedeutet wie molare Konzentration oder Molarität (c in mol/l ). **Die Stoffmengenkonzentration stellt die Konzentration eines Stoffes in einer Lösung dar. Sie ist definiert als die Stoffmenge (Anzahl der Mole einer Substanz oder eines gelösten Stoffes), die pro Liter Lösung (nicht pro Liter Lösungsmittel!) gelöst sind.
Stoffmengenkonzentration = Stoffmenge / Volumen oder
c = n/V
Formel der Stoffmengenkonzentration
Mit der folgenden Gleichung kannst du die Stoffmengenkonzentration einer Lösung berechnen:
Stoffmengenkonzentration = Massenkonzentration / molare Masse
c = β/M
Die Massenkonzentration β gibt die Masse eines Stoffes bezogen auf das Volumen einer Lösung an und wird in Einheiten der Dichte ausgedrückt (normalerweise in g/l oder g/ml).
Die molare Masse M ist die Masse von 1 Mol der gelösten Substanz. Sie wird in Gramm pro Mol ausgedrückt. Sie ist eine konstante Eigenschaft jeder Substanz – die molare Masse von Wasser beträgt zum Beispiel ungefähr 18 g/mol. Die molare Masse eines jeden Elementes findest du im Periodensystem.
Mit unserem Rechner kannst du auch die Masse der Substanz ermitteln, die du zu deiner Lösung hinzufügen musst, um die gewünschte molare Konzentration zu erhalten:
Masse / Volumen = Massenkonzentration = Stoffmengenkonzentration × molare Masse oder
m / V = β = c ∙ M
dabei steht Masse für die Masse des gelösten Stoffes in Gramm und Volumen für das Gesamtvolumen der Lösung in Liter.
🔎 Die Molarität ist eine wichtige Größe in vielen chemischen Berechnungen. Eine davon ist die Berechnung der Lösungsmittelverdünnung. Erfahre mehr im Lösungsverdünnungsrechner 🇺🇸.
Einheiten der Stoffmengenkonzentration
Die Stoffmengenkonzentration wird in der Einheit Mol pro Liter (mol/l) bzw. Mol pro Kubikdezimeter (mol/dm³) angegeben und wird mit dem Formelzeichen c bezeichnet. Die Stoffmengenkonzentration eines gelösten Stoffes wird manchmal durch die Verwendung der chemischen Formel des gelösten Stoffes in eckigen Klammern abgekürzt. Zum Beispiel kann die Konzentration von Hydroxidionen als [OH-] geschrieben werden.
Früher haben Chemiker Konzentrationen als Masse der Lösung / Volumen angegeben. Heutzutage ist das Mol die gebräuchlichste Art, die Menge einer chemischen Substanz anzugeben, daher wird stattdessen häufig die Stoffmengenkonzentration verwendet.
Die Molalität wird im deutschsprachigen Raum mit einem kleinen b bezeichnet, wobei in den USA m gängiger ist. Dasselbe gilt für die Stoffmengenkonzentration, welche im amerikanischen System als großes M bezeichnet wird, bei uns aber als c bekannt ist. Im unteren Abschnitt werden wir genauer auf beide Begriffe eingehen.
Berechnung der Stoffmengenkonzentration
- Wähle deine Substanz. Nehmen wir an, es handelt sich um Salzsäure (HCl).
- Bestimme die molare Masse
Mdeines Stoffes. Für die Salzsäure ist sie gleich 36,46 g/mol. - Bestimme die Massenkonzentration deines Stoffes – du kannst sie entweder direkt eingeben oder die Felder für die Stoffmasse und das Lösungsvolumen ausfüllen. Nehmen wir an, du hast 5 g Salzsäure in einer Lösung von 1,2 Litern.
- Wandle die obigen Ausdrücke um, um die Formel für die Stoffmengenkonzentration zu erhalten. Da
Masse / Volumen = Stoffmengenkonzentration × molare Masseist, istMasse / (Volumen × molare Masse) = Stoffmengenkonzentration. - Setze die bekannten Werte ein, um die Stoffmengenkonzentration zu berechnen:
Stoffmengenkonzentration = 5 / (1,2 ∙ 36,46) = 0,114 mol/l. - Du kannst diesen Stoffmengenkonzentration-Rechner auch verwenden, um die Massenkonzentration oder die molare Masse zu ermitteln. Gib einfach die restlichen Werte in die Felder ein und lass den Rechner die ganze Arbeit für dich erledigen.
Molarität vs. Molalität
Betrachten wir einmal die Unterschiede zwischen diesen beiden ähnlich benannten chemischen Größen: Molarität und Molalität. Wir hoffen, dass jegliche Verwirrung über diese beiden Größen nach dem Lesen dieses Absatzes verschwunden ist.
Beide Begriffe werden verwendet, um die Konzentration einer Lösung auszudrücken, es gibt aber einen wesentlichen Unterschied zwischen ihnen. Die Molarität – also die Stoffmengenkonzentration beschreibt die Stoffmenge pro Volumeneinheit in einer Lösung. Die Molalität beschreibt die Konzentration als die Stoffmenge pro Masseneinheit des Lösungsmittels. Mit anderen Worten: Die Molalität ist die Anzahl der Mole des gelösten Stoffes pro Kilogramm des Lösungsmittels (in dem der gelöste Stoff gelöst ist).
Es ist möglich, von Stoffmengenkonzentration zu Molalität umzurechnen und umgekehrt. Verwende für diese Umrechnung die folgende Formel:
Stoffmengenkonzentration = (Molalität × Dichte_der_Lösung) / (1 + (Molalität × molare_Masse_der_Lösung))
In dieser Tabelle Stoffmengenkonzentration vs. Molalität findest du alle wichtigen Unterschiede zwischen den beiden Begriffen:
Molarität | Molalität | |
|---|---|---|
Definition | Stoffmenge (in Mol) geteilt durch das Volumen (in Litern) der Lösung. | Stoffmenge (in Mol) geteilt durch die Masse (in kg) des Lösungsmittels. |
Symbol | c | m oder b |
Einheit | mol/L | mol/kg |
Temperatur und Druck | abhängig | unabhängig |
Verwendung | öfter verwendet, praktischer im Labor, schneller und einfacher. | Genau, aber seltener verwendet. |
Wenn du dieses Thema weiter vertiefen möchtest, kannst du dir unseren Artikel [Molarität oder Molalität: Die wichtigsten Unterschiede erklärt] (page:27) ansehen.
Bestimmung der Stoffmengenkonzentration durch Titration
Die Titration ist ein Verfahren, mit dem du die Konzentration einer unbekannten Lösung anhand ihrer chemischen Reaktion mit einer Lösung mit bekannter Konzentration ermitteln kannst. Bei diesem Verfahren wird der Titrator (Reagenz mit einer bekannten Konzentration und einem bekannten Volumen) zu einer bekannten Menge der unbekannten Lösung (dem Titrand) hinzugefügt, bis die Reaktion zwischen den beiden Stoffen abgeschlossen ist. Anschließend kannst du die Konzentration des Titrands bestimmen, indem du das Volumen des verwendeten Titrators misst.
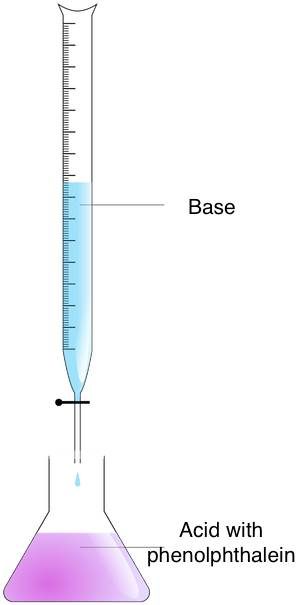
Folge diesen Schritten, um die Stoffmengenkonzentration einer unbekannten Lösung durch Titration zu bestimmen:
- Bereite die Konzentrationen vor – Gib den Titrand in einen Erlenmeyerkolben und den Titrator in eine Bürette.
- Mische die Konzentrationen – Pipettiere den Titrator zum Titrand hinzu, bis der Äquivalenzpunkt erreicht ist. Du kannst diesen Zeitpunkt durch Beobachten des Farbumschlags feststellen. Verwende dazu einen Säure-Base-Indikator. Wenn du Phenolphthalein verwendet hast, wirst du einen Wechsel von rosa zu farblos beobachten können.
- Berechne die Stoffmengenkonzentration – Verwende die Formel zur Titration. Wenn das Verhältnis von Titrator zu Titrand 1:1 ist, verwende die Gleichung:
Säure_Stoffmengenkonzentration × Säure_Volumen = Base_Stoffmengenkonzentration × Base_Volumen.
Wenn das Verhältnis nicht 1:1 ist, muss die Formel angepasst werden.
🙋 Lerne genau, wie du die Konzentration einer Lösung durch Titration berechnen kannst.
Beispiel: 35 ml 1,25 mol/l HCl-Säure werden benötigt, um eine 25 ml Lösung von NaOH zu titrieren. In diesem Fall kannst du die Formel für das Verhältnis von 1:1 verwenden, da ein Mol HCl mit einem Mol NaOH reagiert. Dann multiplizierst du die Stoffmengenkonzentration der Säure mit dem Volumen der Säure – 1,25 ∙ 35 = 43,75 und dividierst das Ergebnis durch das Volumen der Base. Die Stoffmengenkonzentration der Base beträgt 43,75 / 25 = 1,75 mol/l.
🔎 Schau dir unbedingt unseren Alligationsrechner 🇺🇸 an, wenn du wissen möchtest, wie du verschiedene Konzentrationen einer Lösung berechnen und herstellen kannst.
Entstehung des Rechners für die Stoffmengenkonzentration
Das Ausmaß der Bedeutung des Stoffmengenkonzentrations-Rechners ist durchaus nachvollziehbar, da zwei unserer großen Köpfe zusammengearbeitet haben, um dieses praktische Tool ins Leben zu rufen.
Bogna Szyks beruflicher und persönlicher Werdegang zeugt von ihren vielseitigen Talenten und ihrem großen Engagement. Ihre Vorliebe für die Entwicklung praktischer Hilfsmittel, vom Rechner bis zu Datenbanken, zeigt ihr technisches Können und ihren Wunsch, Wissen und Hilfsmittel zum Wohle anderer zu teilen.
Filip Derma kommt aus dem Bereich der Biomedizin und Elektrotechnik.Seine Bereitschaft, sich mit einer Vielzahl von Themen auseinanderzusetzen, zeigt seine Vielseitigkeit und sein Engagement für die Bewältigung verschiedener Herausforderungen und spricht für seine intellektuelle Neugier und Anpassungsfähigkeit.
Filip und Bogna haben gemeinsam an diesem Tool gearbeitet, da sie erkannten, dass die Berechnung der Stoffmengenkonzentration mühsam sein kann. Sie entwickelten den Rechner als praktisches Lehrmittel, um Schülern zu helfen, Konzepte schneller zu verstehen und sie ohne Verwirrung durch Arithmetik in der Praxis anzuwenden..
Wir sorgen dafür, dass du mit unseren Tools die richtige Antwort bekommst und investieren viel Zeit und Mühe, um sicherzustellen, dass unsere Nutzer authentische Informationen erhalten, die sie im Unterricht und in der Praxis anwenden können. Mehr über unser Engagement für Qualität erfährst du in unseren Redaktionsrichtlinien 🇺🇸.
FAQs
Wie berechne ich den pH-Wert aus der Stoffmengenkonzentration?
- Berechne die Konzentration der sauren/alkalischen Komponente deiner Lösung.
- Berechne die Konzentration von H+ oder OH- in deiner Lösung, wenn sie sauer bzw. alkalisch ist.
- Berechne -log[H+] für saure Lösungen. Das Ergebnis ist der pH-Wert.
- Für alkalische Lösungen ermittelst du -log[OH-] und ziehst den Wert von 14 ab.
Wie wird eine 1-molare Lösung hergestellt?
- Finde die molare Masse des Stoffes, den du in eine molare Lösung überführen möchtest, in g/mol.
- Multipliziere die molare Masse des Stoffes mit der Anzahl der Mole, die du erhalten möchtest, was in diesem Fall 1 ist.
- Wiege die in Schritt 2 berechneten Gramm deines Stoffes ab und gib sie in ein Gefäß.
- Miss 1 Liter deines gewählten Lösungsmittels ab und gib es in dasselbe Gefäß. Du hast eine 1-molare Lösung hergestellt.
Was ist das molare Volumen?
Das molare Volumen Vm ist das Volumen, das ein Mol einer Substanz bei einer bestimmten Temperatur und einem bestimmten Druck einnimmt. Es wird berechnet, indem man die molare Masse durch die Dichte des Stoffes bei den gegebenen Temperatur- und Druckbedingungen teilt.
Wie berechne ich Mol aus der Stoffmengenkonzentration?
- Bestimme die Stoffmengenkonzentration und das Volumen deiner Lösung.
- Achte darauf, dass die Einheiten für das Volumen dieselben sind wie für den Volumenteil der Stoffmengenkonzentration (z. B. l und mol/l).
- Multipliziere das Volumen mit der Stoffmengenkonzentration. Das entspricht der Anzahl der vorhandenen Moleküle (Mole).
Ist die Stoffmengenkonzentration dasselbe wie die Konzentration?
Stoffmengenkonzentration ist nicht dasselbe wie Konzentration, obwohl sie sich sehr ähnlich sind. Die Konzentration ist ein Maß dafür, wie viele Mole einer Substanz in einer Flüssigkeitsmenge gelöst sind, und kann in beliebigen Volumeneinheiten angegeben werden. Die Stoffmengenkonzentration ist eine Methode, um die Konzentration einer Lösung auszudrücken, in der Regel in Mol pro Liter.
Wie hoch ist die Stoffmengenkonzentration von Wasser?
Wasser hat eine Stoffmengenkonzentration von 55,5 mol/l. 1 Liter Wasser wiegt 1000 g. Da die Stoffmengenkonzentration die Anzahl der Mole pro Liter angibt, ist die Bestimmung der Stoffmengenkonzentration von Wasser äquivalent zur Bestimmung der Anzahl der Wassermole in 1000 g. Um die Stoffmengenkonzentration zu berechnen, dividieren wir die Masse durch die molare Masse: 1000 / 18,02 = 55,5 mol/l.
Warum verwenden wir die Stoffmengenkonzentration?
Die Stoffmengenkonzentration ist ein hilfreiches Maß zur Bestimmung der Konzentration. Da es für die Angabe der Konzentration eine große Bandbreite an Einheiten gibt, von Nanogramm pro Milliliter bis hin zu Tonnen pro Gallone, ist es einfacher, ein einheitliches Maß für den schnellen Vergleich von Konzentrationen zu verwenden, ohne sich mit Umrechnungen beschäftigen zu müssen. Das ist die Stoffmengenkonzentration (c), die in Mol pro Liter angegeben wird.