Dieser pH-Wert-Rechner ermöglicht es dir, den pH-Wert einer Lösung auf unterschiedliche Weisen zu bestimmen. Er kann den pH-Wert in H+ umrechnen sowie den pH-Wert aus der Säurekonstante und der Konzentration berechnen. Sowohl in der Chemie und Medizin, als auch im täglichen Leben ist der pH-Wert ein wichtiges Maß zur Charakterisierung der Eigenschaften von Substraten. In den folgenden Abschnitten erklären wir dir, was die pH-Skala und die pH-Formel sind und wie du sie verwendest. Schließlich wirst du erfahren, wie du den pH-Wert berechnen kannst und wir gehen anhand eines Beispiels zusammen durch eine leicht verständliche Schritt-für-Schritt Lösung.
Möglicherweise fragt dich unser Rechner nach der Konzentration deiner Lösung. Falls du diese nicht kennst, kannst du sie mit unserem Konzentrationsrechner berechnen. Du kannst auch den Verdünnungsrechner 🇺🇸 verwenden, um die Konzentration der Ionen in verdünnter Lösung zu berechnen.
So benutzt du den pH-Wert Rechner
Ein pH-Wert-Rechner ist ein unschätzbares pädagogisches Werkzeug, das Schülern und Lehrern gleichermaßen hilft. Lass uns also eintauchen und sehen, wie dieser pH-Wert-Rechner dein Leben in ein paar einfachen Schritten vereinfachen kann.
Als Erstes musst du dich entscheiden, wie du den pH-Wert berechnen möchtest. Wir erklären dir die Schritte, die bei jeder Option nötig sind:
Aus der Konzentration einer Säure:
-
Der Rechner schlägt dir eine Liste mit einigen gängigen Säuren vor. Bitte wähle eine davon aus.
-
Als Nächstes gibst du die Stoffmengenkonzentration ein.
-
Das Tool wird sofort den pH-Wert und die Konzentration der Wasserstoffionen ermitteln.
-
Wenn du deine Säure nicht in der Liste der Optionen findest, wähle die Option Benutzerdefiniert.
- Gib den Wert der Ionisationskonstante (Ka) deiner Säure zusammen mit der Konzentration ein.
-
Das Tool berechnet die pH- und H⁺-Werte anhand der eingegebenen Informationen.
Aus der Konzentration einer Base:
-
Die Berechnung des pH-Wertes einer Base erfolgt auf die gleiche Weise wie für die oben genannten Säuren.
-
Der einzige Unterschied besteht darin, dass du die Ionisationskonstante (Kb) einer Base anstelle von Ka eingibst, wenn du die Base deiner Wahl nicht in der Liste der Optionen findest und dich für die Eingabe einer eigenen Base entscheidest.
-
Das Tool bestimmt dann sofort die pH- und H⁺-Werte.
Aus der Masse und dem Volumen einer Säure:
-
Wähle die gewünschte Säure aus der Liste der 22 gängigen Säuren aus.
-
Gib das Gewicht der festen Komponente ein. Die Standardeinheit ist Gramm, du kannst aber auch eine andere Gewichtseinheit aus der Liste auswählen. (Vergewissere dich, dass du die Einheit änderst, bevor du den Wert eingibst).
-
Zum Schluss gibst du das Gesamtvolumen der Lösung ein.
-
Das Ergebnis wird als pH-Wert und H⁺ angezeigt.
-
Du kannst auch die Option Benutzerdefiniert wählen, wenn deine Säure nicht in der Liste enthalten ist.
- Gib dann zusätzlich die Ionisationskonstante der Säure Ka ein.
-
Der pH-Wert und H⁺ werden dann sofort auf der Grundlage der angegebenen Informationen berechnet.
Aus der Masse und dem Volumen einer Base:
- Die Berechnung des pH-Wertes für eine Base ist die gleiche wie für die oben erwähnten Säuren.
- Die einzige Ausnahme ist, dass alle Daten, die du eingibst, für deine gewünschte Base gelten.
Aus der Ionenkonzentration:
-
Der pH-Wert kann aus der Ionenkonzentration mit einer der folgenden drei Variablen berechnet werden:
a. Konzentration der Wasserstoffionen [H⁺];
b. pOH-Wert; und
c. Konzentration der Hydroxidionen [OH-]. -
Du kannst eine der Variablen eingeben, und die anderen werden zusammen mit dem Ergebnis berechnet: der pH-Wert.
Erweiterter Modus:
Bei den ersten vier Methoden kannst du dir durch das Klicken auf die Schaltfläche Ähnliche Messwerte den pOH-Wert, die Konzentration der Hydroxidionen [OH-] und den pKa anzeigen lassen.
Die pH-Skala
Die pH-Skala ist eine numerische Skala, mit welcher der Säure- oder Basengehalt einer wässrigen Lösung angegeben wird. Der pH-Wert liegt in der Regel zwischen 0 und 14, kann aber über diese Werte hinausgehen, wenn die Lösung ausreichend sauer/basisch ist. Der pH-Wert ist logarithmisch und steht in umgekehrter Beziehung zur Konzentration von Wasserstoffionen in einer Lösung. Die Formel, welche die Beziehung zwischen pH und H+ darstellt, lautet:
Die Lösung ist sauer, wenn ihr pH-Wert kleiner als 7 ist. Bei pH-Werten größer 7 sprechen wir von einer basischen Lösung (auch als alkalische Lösung bezeichnet). Lösungen mit einem pH-Wert von 7 werden als neutral bezeichnet.
Neben der mathematischen Bestimmung des pH-Wertes können auch pH-Indikatoren verwendet werden. Der am weitesten verbreitete pH-Wert-Test mit pH-Indikatoren ist das Lackmuspapier. Je nach dem pH-Wert der Lösung, in die der Indikator getaucht wurde, kann ein entsprechender Farbumschwung beobachtet werden, welcher bunte pH-Skalen erzeugt:
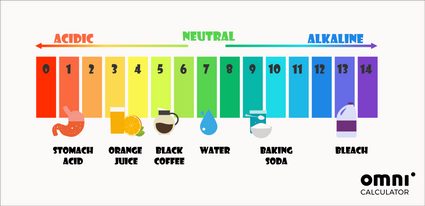
Der pH-Wert in unserem Körper ist nahezu neutral. Beispielsweise sollte der pH-Wert des Blutes bei 7,4 liegen. Die einzige Ausnahme ist unser Magen – die Magensäure kann sogar einen pH-Wert von 1 erreichen.
Moleküle können einen pH-Wert haben, bei dem sie frei von negativer Ladung sind (gleiche Anzahl positiver und negativ geladener Teilchen), wodurch sich ihre Eigenschaften verändern können. Du kannst diesen isoelektrischen Punkt deiner Substanz kurzerhand mit unserem Isoelektrischer Punkt Rechner 🇺🇸 ermitteln.
Definitionen von Säuren und Basen
Drei Theorien definieren Säuren und Basen:
- Nach der Arrhenius Theorie ist eine Säure in einer wässrigen Lösung ein Stoff, der Wasserstoffionen abgeben kann, während eine Base Hydroxidionen abgibt.
- Die Brønsted–Lowry Theorie besagt, dass eine Säure Protonen abgeben kann, während eine Base sie aufnehmen kann.
- Die Lewis Theorie besagt, dass eine Säure eine chemische Verbindung ist, die Elektronenpaare aufnehmen kann. Analog dazu gibt eine Base Elektronenpaare ab.
Je höher die Konzentration der Wasserstoffionen von Säuremolekülen ist, desto niedriger ist der pH-Wert der Lösung und desto saurer ist diese Lösung. Hydroxidionen und Basen verhalten sich dementsprechend umgekehrt: Je höher die Konzentration der Hydroxidionen von Basenmolekülen ist, desto höher ist der pH-Wert der Lösung und folglich auch ihre Basizität.
Wir können die Reaktion einer Säure, HA, in Wasser folgendermaßen beschreiben:
Daraus kann die Säurekonstante Ks (in manchen Quellen aus dem Englischen auch als Ka angegeben) berechnet werden:
Eine ähnliche chemische Reaktion findet zwischen der Base BOH und Wasser statt:
Die nächste Gleichung gibt die Dissoziationskonstante Kb für die obige Formel an:
Um mehr über chemische Gleichgewichtskonstanten zu erfahren, verwende unseren Gleichgewichtskonstanten Rechner oder schau dir den Reaktionsquotienten Rechner 🇺🇸 an.
Wie man den pH-Wert bestimmt – pH-Formel
Der pH-Wert ist definiert als das Negative des Logarithmus zur Basis 10 der molaren Konzentration der in der Lösung vorhandenen Wasserstoffionen. Die Wasserstoffionenkonzentration wird in der Einheit „Mol pro Liter“ angegeben. Um den pH-Wert zu bestimmen, kannst du diese pH zu H⁺ Formel verwenden:
Wenn du die Konzentration der Ionen mithilfe eines bekannten pH-Wertes berechnen möchtest, verwende einfach die folgende umgewandelte pH-Gleichung:
Weniger bekannt als die pH-Skala ist die pOH-Skala. Der pOH ist das Negative des Logarithmus der Hydroxidionenkonzentration:
oder:
pH und pOH sind durch die nachfolgende Gleichung miteinander verbunden:
Wie berechnet man den pH-Wert? – Schritt-für-Schritt-Anleitung
Mit den folgenden Schritten kannst du den pH-Wert einer Lösung berechnen:
-
Nehmen wir an, unsere Wasserstoffionenkonzentration = 0,0001 mol/L.
-
Wir wollen den pH-Wert mit Hilfe der Formel pH zu H+ berechnen:
- Wir können nun unter Zuhilfenahme der folgenden Formeln den pOH-Wert und die Konzentration der Hydroxidionen bestimmen:
Natürlich musst du diese Berechnungen nicht alle von Hand durchführen, dafür haben wir den Rechner! Wähle dazu die Option zur Bestimmung des pH-Wertes mit Ionenkonzentration und gib einen dieser vier Werte ein! Du wirst sehen, wie der Rechner die Arbeit für dich erledigt!
- Alternativ kannst du auch eine Chemikalie aus den Listen (Säuren oder Basen) auswählen. Nehmen wir an, du möchtest den pH-Wert von Ameisensäure –
HCOOH– bestimmen. DeinKsist0,00018. - Wähle dazu die Konzentration der Chemikalie. Nehmen wir an, dass diese
0,1 mol/Lentspricht. - Um die Konzentration der H+-Ionen zu finden, musst du:
wobei:
Dabei ist die Stoffmengenkonzentration der Lösung und die Stoffmengenkonzentration von H⁺.
Für 0,1 M HCOOH:
Jetzt weißt du, wie du den pH-Wert mithilfe der pH-Gleichungen berechnen kannst.
Falls dir die Berechnung zu zeitaufwendig ist, kannst du dir die Arbeit auch abnehmen lassen und unseren praktischen pH-Wert-Rechner nutzen. Wähle dafür einfach die Chemikalie und ihre Konzentration aus.
Der Autor hinter dem pH-Wert Rechner
Biochemiker, Umweltwissenschaftler und Materialwissenschaftler müssen häufig pH-Werte für ihre Forschung berechnen oder anpassen. Julia erkannte, dass ein pH-Wert-Rechner diese Prozesse beschleunigen und effizientes Experimentieren ermöglichen würde.
Ich bin Julia Żuławińska, der Kopf hinter diesem pH-Wert-Rechner. Ich bin eine herausragende Persönlichkeit in der wissenschaftlichen Gemeinschaft, insbesondere in der Biophysik und der molekularen Biotechnologie. Meine Arbeit verkörpert die Schnittstelle zwischen Wissenschaft und Nachhaltigkeit und unterstreicht meine Rolle als vorausschauende Forscherin, mit der ich zum Umweltschutz und zu biotechnologischen Innovationen beitrage.
Durch die Überwachung des pH-Werts natürlicher Gewässer können Verschmutzungsquellen und der Zustand von Ökosystemen ermittelt werden. Umweltwissenschaftler/innen könnten pH-Wert-Rechner verwenden, um die Wasserqualität sofort zu beurteilen.
Wir stellen sicher, dass unsere Werkzeuge auf authentischen Informationen und neuster Forschung basieren. Der Rechner wird von mehreren Experten erstellt, gründlich überprüft und anschließend von einem Muttersprachler Korrektur gelesen. Erst dann wird das Tool für unsere Nutzer/innen freigegeben. Mehr über unser Engagement für Qualität erfährst du in unseren Redaktionsrichtlinien 🇺🇸.
FAQs
Was ist der pH-Wert?
Der pH-Wert misst die Konzentration der positiv geladenen Wasserstoffionen in einer Lösung. Diese Größe korreliert mit der Säure einer Lösung: Je höher die Wasserstoffionenkonzentration in der Lösung, desto niedriger ist der pH-Wert. Diese Korrelation ergibt sich aus der Tendenz einer sauren Substanz zur Dissoziation in Wasser (Zerfallen der Säuremoleküle unter Bildung von positiv geladenen Wasserstoffionen H+): je höher ihr Dissoziationsgrad, desto höher der Säuregrad.
Wie berechne ich den pH-Wert einer Lösung?
Um den pH-Wert einer Lösung zu berechnen:
-
Miss zuerst die Konzentration der Wasserstoffionen in deiner Lösung. Alternativ kannst du auch die Aktivität der Wasserstoffionen messen. Wir bezeichnen den Wert als
[H+]. -
Berechne anschließend den Basis 10 Logarithmus dieses Wertes:
log10([H+]). -
Bestimme letztendlich die Gegenzahl dieser Größe. Der pH-Wert ist gegeben durch:
pH = - log10([H+])
Was ist der Unterschied zwischen pH und pOH?
Der pOH-Wert ist der analoge Wert zum pH-Wert und gibt die Konzentration von Hydroxidionen in einer Lösung an. Die Formel für den pOH-Wert lautet:
pOH = -log10([OH-])
Unter bestimmten Bedingungen (wässrige Lösungen bei Raumtemperatur) können wir die folgende Beziehung zwischen pH und pOH feststellen:
pH = 14 - pOH
Was sind Beispiele für pH-Werte?
Hier sind ein paar spannende Beispiele für pH-Werte aus dem Alltag:
- Der pH-Wert von reinem Wasser liegt bei
7. Dies entspricht dem neutralen (mittleren) Wert der pH-Skala. - Der pH-Wert unseres Magens schwankt zwischen
1,5und3,5: Du siehst, er erzeugt ein ziemlich saures Milieu! - Die Säure in deiner Autobatterie hat einen noch saureren pH-Wert von etwa
0,5: Vermeide jeglichen Hautkontakt! - Haushaltsprodukte wie Abflussreiniger sind starke Basen: Einige von Ihnen können einen pH-Wert von
14erreichen!