Calculateur de concentration molaire
Ce calculateur de concentration molaire permet de convertir la concentration massique d'une solution en concentration molaire (soit recalculer les grammes par millilitre en moles). Vous pouvez également calculer la masse de soluté nécessaire pour atteindre une concentration molaire souhaitée. Cet article vous fournira la définition et la formule de la concentration molaire – appelée aussi molarité ou taux molaire.
Pour bien comprendre le sujet, il est nécessaire d'apprendre la définition de la mole, les unités de la concentration molaire, et de connaître la différence entre la formule de la concentration molaire et celle de la molalité 🇺🇸. De plus, nous avons préparé pour vous des exemples intéressants de solutions molaires et un court tutoriel sur la façon de calculer la concentration molaire d'une solution.
En fin d'article, vous pourrez même apprendre la définition du titrage et découvrir comment trouver la concentration molaire en utilisant le processus de titrage !
La concentration molaire – une introduction
La plupart des objets que nous voyons autour de nous, même chez nous, sont créés à partir de divers matériaux. La majorité de ces matériaux ne sont pas purs. Il s'agit en fait de mélanges.
Les mélanges sont composés d'une multitude de différents constituants. Il peut y en avoir beaucoup comme peu, mais tant qu'il y a plus d'un élément dans un objet, il s'agit d'un mélange. Le jus d'orange, le thé, les détergents et le lait sont tous des mélanges.
Les mélanges ne sont pas limités aux liquides ; les solides et les gaz peuvent aussi en être. Même les organismes biologiques sont des mélanges complexes de molécules, de gaz et d'ions dissous dans l'eau.
En chimie, il existe deux types de mélanges.
-
Les mélanges homogènes – Les constituants sont uniformément répartis, de sorte que l'on n'observe qu'une seule phase de la matière. Ils sont également connus sous le nom de solutions et peuvent exister à l'état solide, liquide ou gazeux. Il est difficile de séparer les constituants d'un mélange homogène. Voici quelques exemples de mélanges homogènes : l'eau sucrée, le produit vaisselle, l'acier, le liquide lave-glace, l'air…
-
Les mélanges hétérogènes – Les constituants ne sont pas répartis de manière uniforme, de sorte que l'on peut observer plusieurs phases. Différents échantillons du mélange peuvent présenter des propriétés différentes. Un mélange hétérogène est au moins composé de deux phases. Il est généralement possible de le séparer physiquement. Quelques exemples de tels mélanges : le sang, le béton, les glaçons dans le coca, la pizza, l'océan Pacifique…
La concentration est l'un des paramètres les plus connus et les plus importants pour quiconque travaille avec des mélanges ou des réactions chimiques. Elle mesure la quantité d'un soluté dissout dans un volume donné de solution.
Les chimistes utilisent de nombreuses unités pour décrire la concentration. Que les réactifs (constituants) soient exprimés en mole est très utiles, car cela permet d'utiliser des nombres entiers dans les réactions chimiques et donc, pour nous, de travailler avec des quantités plus faciles. Tout d'abord, examinons de plus près ce qu'est la mole, afin de pouvoir déterminer plus tard ce qu'est la concentration molaire.
Définition de la mole
La mole est l'unité de mesure SI pour la quantité de matière. La définition actuelle a été adoptée en 1971 et est basée sur le carbone 12. Elle se lit comme suit :
« La mole est la quantité de matière d'un système qui contient autant d'entités élémentaires qu'il y a d'atomes dans 0,012 kilogrammes de carbone 12 ; son symbole est « mol ». Lorsque la mole est utilisée, les entités élémentaires doivent être spécifiées et peuvent être des atomes, des molécules, des ions, des électrons, d'autres particules ou des groupes spécifiés de ces particules. »
Il s'ensuit que la masse molaire du carbone 12 est exactement de 12 grammes par mole, M(¹²C) = 12 g/mol. Le mot « matière » dans la définition doit spécifier (être remplacé par le nom de) la matière concernée dans une application particulière, par exemple la quantité de chlorure (HCl) ou la quantité de dioxyde de carbone (CO₂). Il est essentiel de toujours donner une spécification précise de l'entité concernée (comme indiqué dans la deuxième partie de la définition de la mole). Pour ce faire, il convient de fournir la formule chimique empirique du constituant concerné.
Selon les conventions les plus récentes (en vigueur depuis le 20 mai 2019), la définition de la mole est la suivante : une mole est la quantité en chimie d'une matière qui contient précisément 6,022 140 76 × 1023 particules, telles que des atomes, des molécules, des ions, etc. Ce nombre est connu sous le nom de la constante ou le nombre d'Avogadro. Son symbole est NA ou L. L'utilisation du nombre d'Avogadro 🇺🇸 est un moyen pratique de considérer la masse d'une matière et le rendement théorique des réactions chimiques. Les moles vous permettent de lire directement la masse dans le tableau périodique (par exemple, 1 mole de N₂ pèse 28 g ou 1 mole de NaCl pèse 58,5 g).
Nous pouvons relier le nombre d'entités X dans un échantillon donné, N(X), au nombre de moles de X dans le même échantillon, n(X), avec la relation : n(X) = N(X)/NA. N(X) est sans dimension et n(X) a pour unité SI la mole.
Qu'est-ce que la molarité ?
Afin de ne pas vous embrouiller avec des termes similaires en chimie, gardez à l'esprit que concentration molaire signifie exactement la même chose que molarité. La molarité exprime la concentration d'une solution. Elle est définie comme le nombre de moles d'une matière ou d'un soluté dissous par litre de solution (et non par litre de solvant !).
concentration molaire = nombre de moles / volume
Formule de la concentration molaire
L'équation suivante vous permet de trouver la concentration molaire d'une solution :
concentration molaire = concentration massique / masse molaire
La concentration massique est exprimée en unités de masse volumique (généralement g/L ou g/mL).
La masse molaire est la masse d'une mole de soluté. Elle est exprimée en grammes par mole. Il s'agit d'une propriété constante à chaque matière – par exemple, la masse molaire de l'eau est approximativement égale à 18 g/mol.
Notre calculateur peut également déterminer la masse d'une matière que vous devez ajouter à votre solution pour obtenir la concentration molaire souhaitée, selon la formule :
masse / volume = concentration massique = concentration molaire × masse molaire
où :
masse – masse du soluté en grammes
volume – volume total de la solution en litres
🔎 La concentration molaire a de nombreuses applications. L'une d'entre elles est le calcul de la dilution d'une solution. Pour en savoir plus, consultez notre calculateur de dilution de solution 🇺🇸.
Unités de la concentration molaire
Les unités de la concentration molaire sont les moles par litre. Elles sont notées mol/L. La concentration molaire d'un soluté est parfois abrégée en plaçant des crochets autour de la formule chimique du soluté, par exemple, la concentration des anions hydroxydes peut être écrite sous la forme [OH-]. Dans de nombreux ouvrages, vous pouvez trouver différentes unités de solutions molaires – moles par décimètre cube (mol/dm³). Rappelez-vous qu'un décimètre cube équivaut à un litre, de sorte que ces deux notations expriment les mêmes valeurs numériques.
Autrefois, les chimistes donnaient les concentrations comme la « masse du soluté/volume ». De nos jours, la mole étant devenue la manière la plus courante d'écrire la quantité d'une matière, la concentration molaire est couramment utilisée à la place.
Notez que la concentration molaire peut être assez souvent confondue avec la molalité. La molalité s'écrit généralement avec un b minuscule, tandis que la concentration molaire peut s'écrire avec un C majuscule. Nous expliquons la différence entre ces deux termes dans un futur paragraphe.
Comment calculer la concentration molaire ?
- Choisissez votre soluté. Supposons qu'il s'agisse de l'acide chlorhydrique (HCl).
- Trouvez la masse molaire de votre soluté. Pour l'acide chlorhydrique, elle est égale à 36,46 g/mol.
- Déterminez la concentration massique de votre soluté – vous pouvez soit l'entrer directement, soit remplir les champs correspondant à la masse du soluté et au volume de la solution. Supposons que vous ayez 5 g de HCl dans une solution de 1,2 L.
- Convertissez les expressions ci-dessus pour obtenir une formule de la concentration molaire. Comme
masse / volume = concentration molaire × masse molaire, alorsmasse / (volume × masse molaire) = concentration molaire. - Substituez les valeurs connues pour calculer la concentration molaire :
concentration molaire = 5 / (1,2 × 36,46) = 0,114 mol/L = 0,114 C. - Vous pouvez également utiliser ce calculateur de concentration molaire pour trouver la concentration massique ou la masse molaire. Il vous suffit de saisir les valeurs restantes et le calculateur fait tout le travail à votre place.
Concentration molaire vs molalité
Examinons les différences entre ces deux concepts en chimie : la concentration molaire et la molalité. Nous espérons qu'après avoir lu ce paragraphe, vous n'aurez plus aucun doute à ce sujet.
Les deux termes sont utilisés pour exprimer la concentration d'une solution, mais il existe une différence significative entre eux. Alors que la concentration molaire décrit la quantité de matière par unité de volume de solution, la molalité définit la concentration comme la quantité de matière par unité de masse de solvant. En d'autres termes, la molalité est le nombre de moles de soluté (matière dissoute) par kilogramme de solvant (dans lequel le soluté est dissous).
Il est possible de passer de la concentration molaire à la molalité et inversement. Pour ce faire, utilisez la formule ci-dessous :
concentration molaire = (molalité × concentration_massique_de_la_solution) / (1 + (molalité × masse_molaire_du_soluté))
Dans ce tableau concentration molaire vs molalité, vous trouverez les principales différences entre ces deux termes :
Concentration molaire | Molalité | |
|---|---|---|
Définition | Quantité de matière (en moles) divisée par le volume (en litres) de la solution. | Quantité de matière (en moles) divisée par la masse (en kg) du solvant. |
Symbole | C | b |
Unité | mol/L | mol/kg |
Température et pression | Dépendante | Indépendante |
Utilisation | Plus populaire, pratique à utiliser en laboratoire, plus rapide et plus facile | Précise, mais rarement utilisé |
Si vous souhaitez approfondir ce sujet, n'hésitez pas à consulter notre article Molarité vs. Molalité : comprendre les principales différences 🇺🇸.
Solution molaire – exemples pratiques
Comme vous le savez déjà, les mélanges et les solutions font partie intégrante de notre environnement. Dans le tableau ci-dessous, vous trouverez la liste des ordres de grandeur de la concentration molaire, avec des exemples tirés du milieu naturel.
Concentration molaire | Préfixe SI | Valeur | Exemple |
|---|---|---|---|
10⁻¹⁵ | fM | 2 fM | Bactéries présentes à la surface de l'eau de mer (1×10⁹/L) |
10⁻¹⁴ | – | 50–100 fM | Or dans l'eau de mer |
10⁻¹² | pM | 7,51–9,80 pM | Plage normale pour les érythrocytes dans le sang d'un homme adulte |
10⁻⁷ | – | 101 nM | Ions hydronium et hydroxyde dans l'eau pure à 25 °C |
10⁻⁴ | – | 180–480 µM | Plage normale pour l'acide urique dans le sang |
10⁻³ | mM | 7,8 mM | Limite supérieure d'une glycémie saine 2 heures après le repas |
10⁻² | cM | 44,6 mM | Gaz parfait pur à 0 °C et 101,325 kPa |
10⁻¹ | dM | 140 mM | Ions sodium dans le plasma sanguin |
10² | hM | 118,8 M | Osmium pur à 20 °C (22,587 g/cm³) |
10⁴ | myM | 24 kM | Hélium dans le noyau solaire (150 g/cm³ × 65 %) |
Déterminer la concentration molaire par titrage
Le titrage est une technique qui permet de déterminer la concentration d'une solution inconnue, en se basant sur sa réaction chimique avec une solution de concentration connue. Ce processus consiste à ajouter le réactif titrant (dont la concentration et le volume sont connus) à une quantité connue de la solution inconnue (l'analyte) jusqu'à ce que la réaction soit complète. Vous pouvez ensuite déterminer la concentration de l'analyte en mesurant le volume de réactif titrant utilisé.
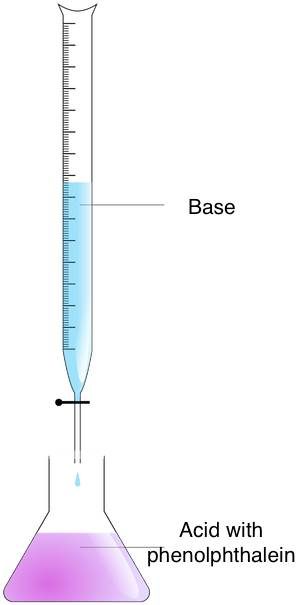
Suivez ces étapes pour trouver la concentration molaire d'une solution inconnue à l'aide de la méthode de titrage :
- Préparez les concentrations – Mettez l'analyte dans un erlenmeyer et le réactif de titrage dans une burette.
- Mélangez les concentrations – Ajoutez le réactif de titrage à l'analyte jusqu'à ce que le point final soit atteint. Vous pouvez trouver le moment précis en observant le changement de couleur. Utilisez l'indicateur acido-basique à cette fin. Si vous avez utilisé de la phénolphtaléine, vous remarquerez un changement passant du rose à incolore.
- Calculez la molarité – Utilisez la formule de titrage. Si le rapport réactif de titrage/analyte est de 1:1, utilisez l'équation suivante :
concentration_molaire_acide × volume_acide = concentration_molaire_base × volume_base.
Pour les rapports autres que 1:1, vous devez modifier la formule.
🙋 Apprenez à calculer les titrages avec le calculateur de titrage 🇺🇸.
Exemple : 35 mL d'acide HCl à 1,25 C sont nécessaires pour titrer une solution de 25 mL de NaOH. Dans ce cas, vous pouvez utiliser la formule 1:1, car une mole de HCl réagit avec une mole de NaOH. Ensuite, multipliez la concentration molaire de l'acide par le volume de l'acide : 1,25 × 35 = 43,75 et le résultat par le volume de la base. La concentration molaire de la base est alors égale à : 43,75 / 25 = 1,75 C.
🔎 N'oubliez pas de consulter notre calculateur d'alligation 🇺🇸 si vous souhaitez savoir comment obtenir différentes concentrations d'une solution.
Derrière la création du calculateur de concentration molaire
Vous pouvez comprendre l'importance du calculateur de concentration molaire, car deux de nos grands cerveaux d'Omni Calculator ont collaboré pour donner naissance à cet outil commode.
Le parcours professionnel et personnel de Bogna Szyk témoigne de ses talents multiples et de son dévouement. Son amour pour le développement d'outils pratiques, des calculateurs aux bases de données Notion, témoigne de ses compétences techniques et de son désir de partager ses connaissances et ses outils pour le bien d'autrui.
Filip Derma est une personnalité distincte et crédible dans le domaine de l'ingénierie biomédicale et électrique. Sa volonté d'aborder différents sujets souligne sa polyvalence et son empressement à relever divers défis, ce qui témoigne d'une curiosité intellectuelle et d'une capacité d'adaptation remarquables.
Filip et Bogna ont collaboré à la création de cet outil, réalisant que les calculs de concentration molaire pouvaient être fastidieux et qu'un calculateur de molarité serait un aide pédagogique pratique, aidant les étudiants à saisir les concepts plus rapidement et à les appliquer dans des scénarios pratiques sans être déroutés par l'arithmétique.
Nous veillons à ce que nos outils vous donnent la bonne réponse et nous consacrons beaucoup de recherches et d'efforts pour nous assurer que des informations authentiques sont fournies à nos utilisateurs, qu'ils peuvent appliquer dans des scénarios éducatifs et pratiques. Pour en savoir plus sur notre engagement en matière de qualité, veuillez consulter notre politique éditoriale 🇺🇸.
FAQ
Comment calculer le pH à partir de la concentration molaire ?
- Calculez la concentration du constituant acide/alcalin de votre solution.
- Calculez la concentration de H+ ou de OH- dans votre solution si celle-ci est respectivement acide ou alcaline.
- Calculez -log[H+] pour les solutions acides. Le résultat est le pH.
- Pour les solutions alcalines, calculez -log[OH-] et soustrayez-y 14.
Comment prépare-t-on une solution molaire ?
- Trouvez la masse moléculaire du soluté nécessaire pour obtenir une solution molaire en g/mol.
- Multipliez la masse moléculaire du soluté par le nombre de moles que vous souhaitez obtenir, soit 1 dans ce cas.
- Pesez le nombre de grammes de votre soluté calculé à l'étape 2 et mettez-le dans un récipient.
- Mesurez 1 litre du solvant que vous avez choisi et ajoutez-le au même récipient. Vous avez maintenant une solution molaire.
Qu'est-ce que le volume molaire ?
Le volume molaire est le volume occupé par une mole de matière à température et pression données. Il est obtenu en divisant la masse molaire par la masse volumique de la matière à cette température et à cette pression.
Comment trouver le nombre de moles à partir de la concentration molaire ?
- Trouvez la concentration molaire et le volume de votre solution.
- Assurez-vous que les unités pour le volume sont les mêmes que pour la partie volume de la concentration molaire (par exemple, mL et mol/mL).
- Multipliez le volume par la concentration molaire. Vous obtiendrez ainsi le nombre de moles présentes.
La molarité est-elle la même chose que la concentration ?
La molarité n'est pas la même chose que la notion de concentration en général ; elle a besoin de plus de précision. La concentration est une mesure du nombre de moles d'un soluté dissout dans une quantité de liquide, et peut avoir n'importe quelle unité de volume. Sans spécification, la concentration peut être la molarité ou molalité par exemple. C'est pour cela que lorsque l'on parle de molarité, on spécifie que la concentration est molaire. La molarité est un type de concentration, précisément une concentration en moles par litre de solution.
Quelle est la concentration de l'eau ?
La concentration molaire de l'eau est de 55,5 C. 1 L d'eau pèse 1 000 g. Comme la concentration molaire est le nombre de moles par litre, trouver la concentration molaire de l'eau revient à trouver le nombre de moles d'eau dans 1 000 g. On divise donc la masse de l'eau par la masse molaire pour obtenir les moles : 1 000 / 18,02 = 55,5 C.
Pourquoi utilise-t-on la concentration molaire ?
La concentration molaire est une mesure utile à utiliser lorsque l'on parle de concentration. Étant donné que la concentration présente une large gamme d'unités, allant du nanogramme par millilitre à la tonne par gallon, il est plus facile d'avoir une mesure connue pour comparer rapidement les concentrations sans avoir à se préoccuper des conversions. Il s'agit de la concentration molaire (C), qui correspond aux moles par litre.
Comment utiliser le calculateur de concentration molaire ?
Le calculateur de concentration molaire est facile à utiliser et, vous le découvrirez bientôt. Mais saviez-vous à quel point le calcul de la concentration molaire est important ? Le maintien de la qualité des produits et le respect des règles de sécurité nécessitent de déterminer la concentration molaire de constituants ou d'additifs spécifiques dans l'industrie alimentaire et des boissons.
Si vous connaissez la concentration de la solution, entrez-la dans la 4ᵉ variable du calculateur. Un fait intéressant est que la concentration massique est égale à sa masse volumique pour une substance pure. L'unité par défaut est g/mL, grammes par millilitre, mais vous pouvez la changer à partir des options proposées ; assurez-vous de changer l'unité avant d'entrer la valeur.
Ensuite, insérez le poids moléculaire (ou masse molaire) de la substance. L'unité par défaut est le gramme par mole, mais vous pouvez la modifier avant d'entrer d'autres unités couramment utilisées.
Maintenant, voyez la magie opérer, car le calculateur détermine instantanément la concentration molaire. L'unité par défaut est le molaire (M). Vous pouvez la modifier selon vos besoins à partir de la liste d'options proposée.
Mais que faire si vous ne disposez pas de la concentration massique de la substance ? Comment calculer la concentration molaire ? Notre outil a la réponse à cette question. Dans cette situation, laissez la concentration massique vide.
Entrez la masse de la substance en grammes ou changez l'unité si nécessaire.
Enfin, entrez le volume de la solution.
Notre outil est suffisamment intelligent pour déterminer la concentration massique et la concentration molaire sur la base des informations que vous avez fournies.
Prenons un exemple. Votre substance désirée est l'acide sulfurique, et la masse molaire est 98 g/mol avec une concentration molaire de 10 g/mL. En entrant ces valeurs dans le calculateur, vous obtiendrez une concentration molaire de 102,040 8 M.
Imaginons maintenant que vous ne connaissiez pas la concentration massique de l'acide. Au lieu de cela, vous disposez de la masse et du volume de la solution, soit 970 g de H2SO4 dans une solution de 2,1 L. Le calculateur de molarité vous indiquera que la molarité de votre acide est 4,713 31 M, la concentration molaire étant 0,461 905 g/mL.