Unser Stoffmengenverhältnis-Rechner hilft dir, das Stoffmengenverhältnis zwischen den verschiedenen Reaktanten und den bei der Reaktion entstehenden Chemikalien zu bestimmen. Er kann dir auch helfen, die Masse oder die Molmenge jeder Chemikalie zu bestimmen, die für die Reaktion benötigt wird. Mit diesem Wissen kannst du den begrenzenden Reaktant in der Reaktion finden oder herausfinden, welche Chemikalie im Überschuss vorhanden ist.
Fragst du dich, was ein Stoffmengenverhältnis ist und wie man es berechnet? Möchtest du wissen, wie wichtig das Stoffmengenverhältnis ist? In diesem Artikel erklären wir dir die Definition des Stoffmengenverhältnisses, wie man es mithilfe der Formel für das Stoffmengenverhältnis bestimmt und wie du es nutzen kannst, um mehr Informationen aus deiner ausgewogenen chemischen Gleichung zu erhalten.
Das Stoffmengenverhältnis unterscheidet sich vom Stoffmengenanteil. Unser Stoffmengenanteil Rechner 🇺🇸 hilft dir, wenn du dich für den Stoffmengenanteil deiner Lösung interessierst.
Was ist ein Stoffmengenverhältnis? Was ist die Formel für das Stoffmengenverhältnis?
Ein Stoffmengenverhältnis ist das Verhältnis zwischen der Molmenge (oder Molekülmenge) der verbrauchten Reaktanten und der Mol (oder Moleküle) der erzeugten Produkte in einer chemischen Reaktion. Du kannst es auch ausdrücken als das Verhältnis der Stoffmenge (oder Moleküle) eines Eduktes, die benötigt wird, um vollständig mit einem anderen Reaktanten zu reagieren, oder als das Verhältnis von einem erzeugten Produkt zu einem anderen Produkt.
Wenn zum Beispiel bei der Ammoniakproduktion 30 Mol Wasserstoff vollständig mit 10 Mol Stickstoff zu 20 Mol Ammoniak reagieren, kannst du das molare Verhältnis zwischen den verschiedenen Reaktionspartnern wie folgt ausdrücken:
Wenn du herausfinden möchtest, wie viel von jedem Element in einer Komponente enthalten ist, kann dir unser Prozentuale Zusammensetzung Rechner 🇺🇸 helfen.
Wie berechnet man das Stoffmengenverhältnis?
Um das Stoffmengenverhältnis zwischen zwei beliebigen Elementen oder Komponenten in einer chemischen Reaktion zu bestimmen:
- Bilanziere die chemische Reaktion.
- Erfahre die Koeffizienten der entsprechenden Elemente oder Komponenten in der Gleichung.
- Berechne das Verhältnis zwischen diesen Koeffizienten.
Mit anderen Worten: Die Formel für das Stoffmengenverhältnis zwischen zwei beliebigen Elementen oder Komponenten ist ganz simpel:
wobei:
- — Jedes Element oder jede Verbindung, das/die bei der Reaktion reagiert oder entsteht;
- — Jedes andere Element oder jede Verbindung, die in der Reaktion reagiert oder entsteht;
- — Koeffizient von in der ausgeglichenen chemischen Reaktion; und
- — Koeffizient von in der ausgeglichenen chemischen Reaktion.
Der Koeffizient in einer ausgeglichenen Reaktion ist nützlich, um das Stoffmengenverhältnis zu bestimmen, da der Koeffizient die Anzahl der Moleküle des Elements (oder der Komponente) angibt, die für die Reaktion benötigt werden, ohne dass überschüssige Reaktanden zurückbleiben.
Betrachte zum Beispiel die folgende ausgeglichene chemische Gleichung:
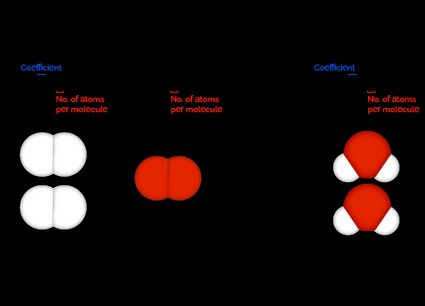
Aus den Koeffizienten dieser ausgeglichenen chemischen Reaktion können wir die folgenden Informationen ableiten:
- Für je zwei Moleküle von wird ein Molekül von benötigt, um vollständig zu reagieren;
- Für je zwei Moleküle von , die reagieren, werden zwei Moleküle von gebildet; und
- Für jedes Molekül von , das reagiert, werden zwei Moleküle von gebildet.
Dieses Ergebnis bedeutet auch, dass wir, wenn wir zwanzig Moleküle Wasserstoff hätten, zehn Moleküle Sauerstoff bräuchten, um vollständig zu reagieren, damit zwanzig Moleküle Wasser entstehen.
Bei jeder ausgeglichenen Reaktion stellt sich dieses Verhältnis zwischen der Anzahl der Moleküle zwischen verschiedenen Edukten und Produkten ein. Ein Mol eines Stoffes ist einfach die Aggregation von Atomen oder Molekülen. Nutze unseren Avogadro Konstante Rechner, um dies besser zu verstehen.
Bedeutung eines Stoffmengenverhältnisses und seiner Gleichung
Nachdem du nun weißt, wie man das Stoffmengenverhältnis einer chemischen Reaktion bestimmt, wollen wir uns nun mit seiner Bedeutung befassen.
Wenn du das Stoffmengenverhältnis kennst, kannst du ausrechnen, wie viel Mol du von jedem Stoff brauchst, damit die Reaktion vollständig abläuft. Wenn zum Beispiel das Stoffmengenverhältnis zwischen zwei Reaktanten 2:3 ist und du des ersten Reaktanten hast, dann ergibt sich die benötigte Molzahl des zweiten Reaktanten wie folgt:
Anhand des Stoffmengenverhältnisses und der Molmasse der Moleküle kannst du die Masse der Elemente (oder Verbindungen) bestimmen, die zur Vervollständigung der Reaktion benötigt werden. Nutze unseren Gramm in Mol Rechner und Molmenge Rechner, um zu verstehen, wie Molekulargewicht und molare Masse einer Komponente zusammenhängen und wie du die Stoffmengenkonzentration in die Masse der benötigten Verbindung berechnen kannst. Wenn du also weißt, wie du das Stoffmengenverhältnis und die Anzahl an benötigten Mol bestimmen kannst, kannst du das Stoffmengenverhältnis in Gramm- oder Massenverhältnis umrechnen:
Da das Stoffmengenverhältnis dabei hilft, zu bestimmen, wie viel von jedem Stoff benötigt wird, um die Reaktion abzuschließen, kannst du es auch verwenden, um herauszufinden, welcher Stoff der begrenzende Reaktant ist und welcher Stoff im Überschuss ist. Wir haben zum Beispiel gesehen, dass das Stoffmengenverhältnis zwischen Wasserstoff und Sauerstoff bei der Wasserproduktion 2:1 beträgt. Wenn wir 12 mol Wasserstoff für 10 mol Sauerstoff hätten, wüssten wir sofort, dass Wasserstoff der begrenzende Reaktant ist, weil die Reaktion 20 mol Wasserstoff benötigt. Wir können ebenfalls feststellen, dass Sauerstoff um 4 mol im Überschuss ist, da nur 6 mol mit 12 mol Wasserstoff reagieren können.
Wie berechent man das Stoffmengenverhältnis mit diesem Stoffmengenverhältnis-Rechner?
Dieser Rechner für Stoffmengenverhältnisse kann bis zu fünf Reaktanten und fünf Produkte berechnen. Außerdem gibt es drei Arten von Berechnungen, die unten erklärt werden. Beachte, dass in all diesen Fällen das resultierende Stoffmengenverhältnis als Tabelle ganz unten im Rechner angezeigt wird.
-
Die Berechnung des Stoffmengenverhältnisses aus einer ausgeglichenen Reaktion ist die einfachste Methode. In diesem Stoffmengenverhältnis-Rechner wählst du für Berechnungsart wählen die Option Stoffmengenverhältnis berechnen aus. Gib dann sorgfältig die Koeffizienten jedes Reaktionspartners und jedes Produkts in das entsprechende Feld Koeffizient ein. Das resultierende Stoffmengenverhältnis erhältst du ganz unten in einer Tabelle.
-
Wenn du das Stoffmengenverhältnis kennst, kannst du die Molzahl der einzelnen Reaktionspartner und Produkte bestimmen, die für die Reaktion benötigt wird. Umgekehrt kannst du das Stoffmengenverhältnis berechnen, wenn du die benötigte Molzahl kennst. Stelle im Rechner zunächst die Berechnungsart auf die Option Stoffmengenverhältnis und Mole berechnen und gib die Koeffizienten oder die Stoffmengenkonzentration sorgfältig in die entsprechenden Felder ein. Du erhältst das resultierende Stoffmengenverhältnis ganz unten in einer Tabelle.
-
Wenn du das Stoffmengenverhältnis, die Stoffmengenkonzentration und das Molekulargewicht der einzelnen Edukte und Produkte kennst, kannst du die Masse der benötigten Edukte und Produkte berechnen. Stelle dafür die Berechnungsart auf die Option Stoffmengenverhältnis, Mol und Masse berechnen. Gib dann die Koeffizienten, die Stoffmenge und die Masse in die entsprechenden Felder ein.
-
Um das Molekulargewicht zu berechnen, müssen wir jedes Element in der Komponente sowie die Anzahl der Atome pro Molekül kennen. Für gibst du z. B. in das erste Feld Atome pro Molekül ein und wählst als Einheit aus. gibst du in das zweite Feld Atome pro Molekül ein und wählst als Einheit aus. Dieser Rechner kann bis zu fünf Elemente pro Reaktionspartner oder Produkt unterstützen.
-
Wir empfehlen dir, das Feld Atome pro Molekül für die Berechnung des Molekulargewichts zu verwenden, aber du kannst auch manuell einen beliebigen Wert in das Feld Molekulargewicht eingeben. Es kann sein, dass der Rechner dich weiterhin mit der Meldung "Anzahl der Atome pro Molekül muss eine positive ganze Zahl sein." auffordert. Das liegt daran, dass der Rechner die Atommassen verwendet, die in den aufgeführt sind, und die Werte, die du verwendest, leicht von diesen abweichen können.
FAQs
Wie berechnet man das Stoffmengenverhältnis aus dem Molekulargewicht?
Um das Stoffmengenverhältnis aus dem Molekulargewicht zu bestimmen, brauchst du die molare Masse jedes Stoffes.
- Rechne das Molekulargewicht des ersten Stoffes in seine molare Masse um.
- Dividiere die Masse des ersten Stoffes durch seine molare Masse, um die Stoffmenge zu erhalten, die bei der Reaktion verwendet (oder erzeugt) wurde.
- Wiederhole die Schritte eins und zwei für den zweiten Stoff, um die Stoffmenge zu erhalten, die bei der Reaktion verwendet (oder erzeugt) wurde.
- Berechne das Verhältnis zwischen der Stoffmenge der beiden Stoffe, um ihr Stoffmengenverhältnis zu erhalten.
Wie hoch ist das Stoffmengenverhältnis zwischen Natrium und Chlor bei der Bildung von Kochsalz?
2:1. Für zwei Mol Natrium wird ein Mol Chlor benötigt, um zwei Mol Natriumchlorid zu bilden, das allgemein als Kochsalz bekannt ist.
Wie rechne ich das Stoffmengenverhältnis in das Volumenverhältnis um?
Das Stoffmengenverhältnis und das Volumenverhältnis sind gleich, wenn alle reagierenden und erzeugten Gase die gleiche Temperatur und den gleichen Druck haben.
- Berechne das Volumenverhältnis von einem Mol des ersten Gases und des zweiten Gases bei ihren jeweiligen Temperaturen und Drücken.
- Multipliziere dieses Verhältnis mit dem Stoffmengenverhältnis, um das Volumenverhältnis zu erhalten.
- Super! Du hast ein komplexes Problem gelöst.
Wie berechnet man das Stoffmengenverhältnis aus der Masse in Gramm?
Um das Stoffmengenverhältnis aus der Masse der Edukte (oder Produkte) zu berechnen, befolge diese einfachen Schritte:
- Berechne die molare Masse der einzelnen Stoffe, indem du ihr Molekulargewicht auswertest.
- Dividiere die Masse des ersten Stoffes durch seine molare Masse, um die Stoffmenge zu erhalten, die bei der Reaktion verwendet (oder erzeugt) wurde.
- Wiederhole Schritt eins für den zweiten Stoff, um die Stoffmenge zu erhalten, die bei der Reaktion eingesetzt (oder erzeugt) wurde.
- Berechne das Verhältnis zwischen der Molzahl der beiden Stoffe, um ihr Stoffmengenverhältnis zu erhalten.